Перейти к:
ФИБРИНОЛИЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА
https://doi.org/10.57256/2949-0715-2025-4-3-12-30
Аннотация
Актуальность. Фибринолиз является важной и неотъемлемой частью системы гемостаза. Действуя параллельно и совместно, системы свертывания крови и фибринолиза защищают организм от избыточного образования тромбов и обтурации кровеносных сосудов, с одной стороны, и способствуют поддержанию гомеостаза, предотвращая избыточную кровопотерю. С другой стороны, в результате нарушения баланса между процессами коагуляции и фибринолиза возникают такие патологические процессы, как геморрагические синдромы или тромбофилии. Система фибринолиза включает в себя не только плазмин, непосредственно расщепляющий фибриновый сгусток, но и систему белков, контролирующих активность плазмина: активаторов и ингибиторов этого процесса.
Цель. Рассмотреть современные представления о процессах разрушения фибринового сгустка, механизмах контроля фибринолиза, виды нарушений этих механизмов и проявления этих нарушений, описать основные тесты для определения активности различных белков и продуктов фибринолиза.
Результаты. В обзоре рассмотрена последовательность реакций расщепления фибрина и фибриногена. Приведены основные активаторы плазминогена и ингибиторы плазмина. Описаны свойства компонетнтов – участников фибринолиза. Также в обзоре показаны основные нарушения фибринолиза: гипо- и гиперфибринолитические состояния с примерами. В конце обзора приведены основные лабораторные тесты, позволяющие оценить активность системы фибринолиза.
Заключение. Фибринолиз является неотъемлемым компонентом системы гемостаза. Фибринолиз предотвращает обтурацию кровеносных сосудов фибриновыми тромбами, осуществляет реканализацию сосудов и восстановление нормального кровотока, кроме того он участвует в патогенезе сердечно-сосудистых и других заболеваний. Понимание клинического значения фибринолиза важно для диагностики и лечения различных заболеваний и состояний, связанных с нарушениями в системе свёртывания крови и тромбообразования. При этом, надо учитывать, что лабораторная диагностика нарушений фибринолитической системы проводится в комбинации с исследованием про- и антикоагулянтов, а также системы тромбоцитов.
Ключевые слова
Для цитирования:
Гуцол Л.О., Егорова И.Э., Семинский И.Ж., Гузовская Е.В., Серебренникова С.Н., Дмитриева Л.А. ФИБРИНОЛИЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА. Байкальский медицинский журнал. 2025;4(3):12-30. https://doi.org/10.57256/2949-0715-2025-4-3-12-30
For citation:
Gutsol L.O., Egorova I.E., Seminsky I.Zh., Guzovskaiia E.V., Serebrennikova S.N., Dmitrieva L.A. FIBRINOLYSIS: MODERN VIEW, PATHOLOGY, DIAGNOSTICS. Baikal Medical Journal. 2025;4(3):12-30. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-3-12-30
Введение
После восстановления целостноcти сосуда необходимость в тромбе исчезает и организм должен растворить фибриновый сгусток для возобновления кровотока. За выполнение этой задачи отвечает система фибринолиза. Целью этой системы является реканализация сосудов и восстановление кровотока, а также локализация фибринового тромба в месте повреждения, что препятствует диссеминированному неконтролируемому тромбообразованию по всему сосудистому руслу [1].
Компоненты этой системы разрушают волокна фибрина с образованием растворимых пептидов, которые в дальнейшем удаляются из сосудистого русла. Система фибринолиза активируется одновременно с системами свертывания и антикоагулянтов.
Механизм фибринолиза
Фибринолитическая (другое название – плазминовая) система – довольно сложная протеолитическая система, состоящая из плазминогена (Рgn), его активаторов, ингибиторов и ферментов, разрушающих плазмин (Рn).
Центральным ферментом фибринолиза является плазмин, гидролизующий фибрин до растворимых продуктов. Рn образуется из Рgn, под действием активаторов. Активаторы превращения плазминогена в плазмин синтезируются эндотелиоцитами и другими клетками.
В кровотоке Рgn встречается в двух основных формах – в виде нативного профермента с NH2-терминальной глутаминовой кислотой – глу-Рgn, и в виде частично подвергшегося протеолизу – с NH2-терминальной аминокислотой лизин – лиз-Рgn. Последний приблизительно в 20 раз быстрее трансформируется физиологическими активаторами в Рn, а также имеет большее сродство к фибрину [2].
После активации системы коагуляции образуется большое количество тромбина, который, отщепляя фибринопептиды, преобразует фибриноген в фибрин. Сначала фибрин полимеризуется за счет образования водородных связей, а затем стабилизируется ковалентными связями при участии фактора XIIIa. Сшитый фибрин обнажает остатки лизина, которые обеспечивают связывающую поверхность для Рgn [3,4]
Конформационные изменения, которые происходят во время полимеризации фибрина, приводят к освобождению специальных участков в D-регионе фибрина, являющихся сайтами связывания (ранее скрытых внутри трехмерной структуры фибриногена) с Pgn и тканевым активатором плазминогена (t-PA) (рис. 1А). Таким образом, только после образования и полимеризации фибрина обнажаются участки связывания для фиксации Pgn, t-PA на поверхности фибрина (рис. 1А).
Пространственное расположение t-PA в этом комплексе позволяет ему расщеплять одну из пептидных связей Pgn, превращая его в Pn (рис. 1Б, В). В отсутствие фибрина t-PA является слабым активатором Pgn, так что только небольшая часть Pn свободно активируется в кровотоке. Однако скорость активации Pgn t-PA увеличивается во много раз, когда эти две молекулы выстраиваются на поверхности фибрина.
Рn, оставаясь соединённым с первоначальным сайтом связывания, начинает расщеплять пептидные связи, образованные остатками лизина или аргинина в близлежащих нитях фибрина. При этом происходит освобождение остатков лизина (или аргинина), которые работают как новый сайт для связывания других молекул Pgn, находящихся близко от фибриновой сетки (рис. 1Г). То есть освобождение этих аминокислотных остатков на фибриновой сетке обеспечивает Pgn доступ к нескольким сайтам связывания, в результате чего включается положительная обратная связь, и скорость фибринолиза увеличивается экспоненциально [5].
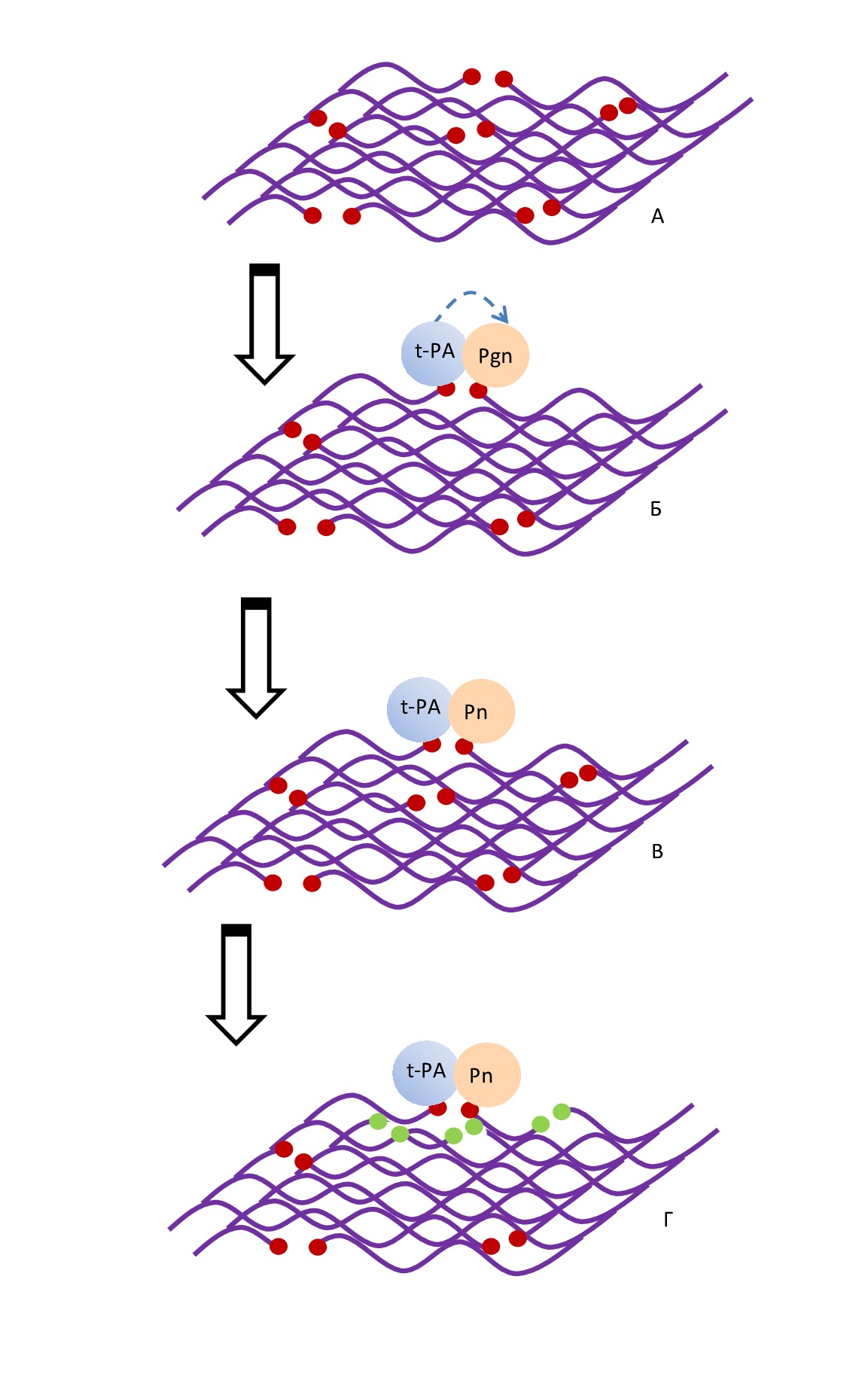
Рис 1. А – освобождение сайтов связывания (обозначены красным цветом) на молекуле фибрина. Б – образование комплекса фибрин-Pgn-t-PA с сайтами связывания. В – прев ращение плазминогена в плазмин. Г – образование новых сайтов связывания образовавшимся плазмином (обозначены зеленым цветом)
Fig. 1. A – release of binding sites (marked in red) on the fibrin molecule. Б – formation of the fibrin-Pgn-t-PA complex with binding sites. В – conversion of plasminogen to plasmin. Г – formation of new binding sites by the formed plasmin (marked in green)
В процессе фибринолиза Pn расщепляет пептидные связи между фрагментами D и Е как в фибрине, так и в фибриногене с образованием продуктов деградации фибрина/фибриногена (ПДФ). При лизисе фибрина Pn не способен разрушить пептидные связи, образовавшиеся в результате полимеризации между двумя фрагментами D. Поэтому в результате разрушения фибрина образуются крупные комплексы D–D (D-димеры) (рис. 2).
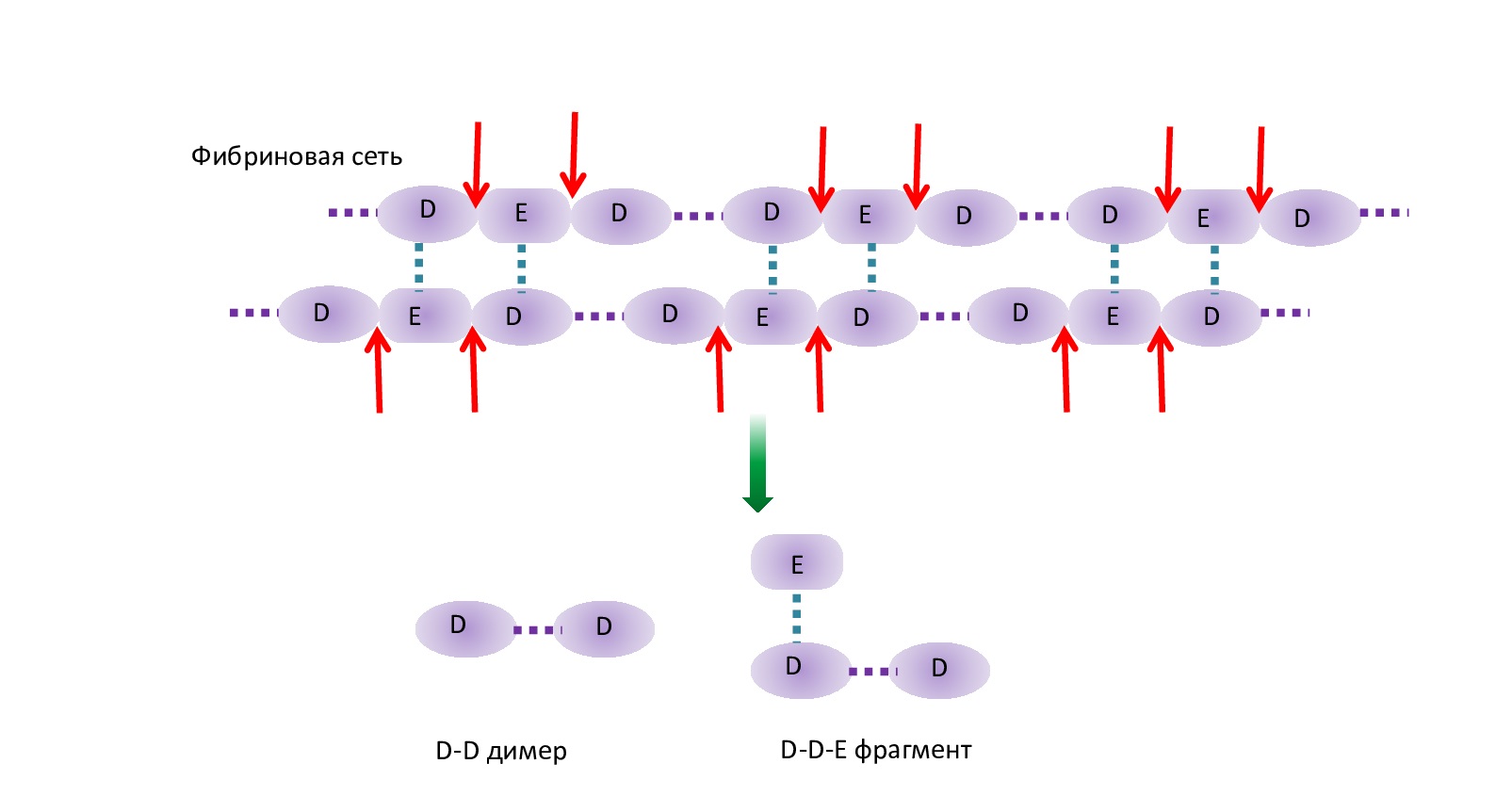
Рис 2. Схема распада молекулы фибрина
Fig. 2. Scheme of fibrin molecule breakdown
В то же время при лизисе фибриногена образуются другие продукты деградации – фрагменты Х, Y, D и Е, (рис. 3). Сначала от α- и β-цепей фибриногена отщепляются низкомолекулярные фрагменты. После их отщепления в плазме крови остаётся крупномолекулярный фрагмент Х, который еще сохраняет способность образовывать фибрин (свёртываться) под влиянием тромбина. Затем под влиянием Pn фрагмент Х расщепляется на фрагменты Y и D, а фрагмент Y – на фрагменты D и Е. Образовавшиеся пептиды X и Y активируют фибринолиз, а пептиды D и Е его тормозят. Растворимые пептиды X, Y, D, E поступают в кровоток и там фагоцитируются.
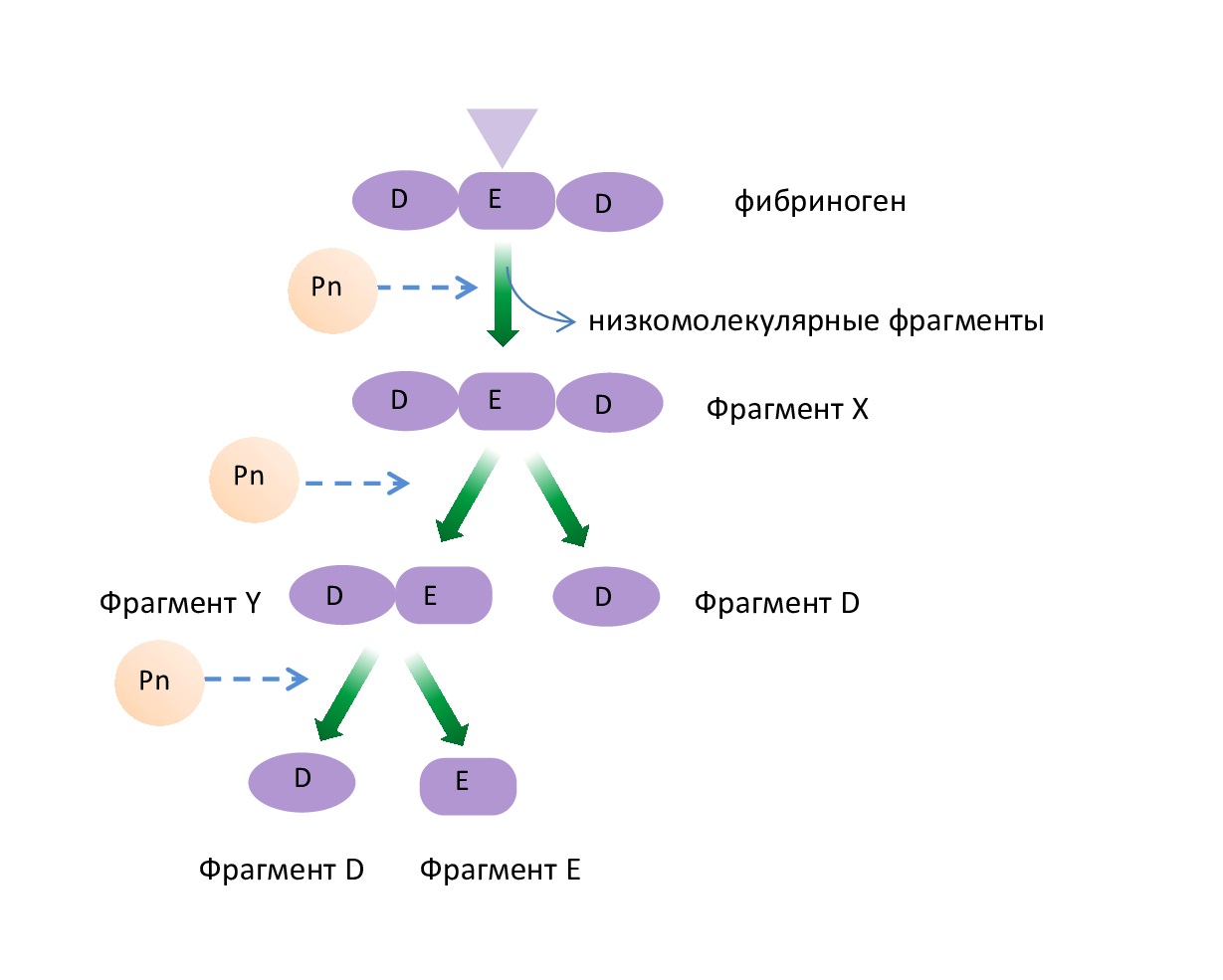
Рис 3. Схема распада молекулы фибриногена
Fig. 3. Scheme of fibrinogen molecule breakdown
Крупномолекулярные фрагменты фибринолиза (фрагменты Х и Y) получили название «ранние», а фрагменты D и Е – «поздние» или конечные.
Разрушение тромба приводит к освобождению из него плазмина и t-PA. В кровяном русле последние быстро инактивируются специфическими ингибиторами и улавливаются печенью.
Плазмин, являясь неспецифической протеазой, приводит к разрушению многих факторов свертывания, таких как фактор V, VIII, фактор фон Виллебранда и других.
Регуляция фибринолиза
Система фибринолиза должна удалять фибрин не слишком быстро, чтобы поврежденные стенки сосудов успели восстановиться, но и не слишком медленно, чтобы предотвратить длительное нарушение кровотока, вызванное обтурацией сосуда фибриновым тромбом. Такое равновесие поддерживается многочисленными ферментами-регуляторами, активирующими или тормозящими фибринолиз.
В норме активаторная и ингибиторная функции фибринолитической системы находятся в динамическом равновесии. Локальное или системное снижение фибринолитической активности приводит к тромбозам, а чрезмерное повышение – к кровотечениям.
Плазмин-индуцированная деградация фибрина проявляется последовательным послойным уменьшением размера тромба. Вначале Pgn накапливается на поверхности сгустка, в результате чего увеличивается его сродство к фибрину. В дальнейшем происходит лизис сгустка, в процессе которого фибриновая сеть становится подвижной и исчезает.
Активация фибринолиза
Pn образуется из Pgn под влиянием двух основных ферментов (рис. 4): активатора плазминогена тканевого типа (t-PA) (в присутствии фибрина) и активатора плазминогена урокиназного типа (u-PA) (в присутствии его клеточного рецептора (u-PAR)). Оба фермента синтезируются в виде одноцепочечной молекулы и под влиянием плазмина и других ферментов превращаются в двухцепочечную, более активную форму.
Способностью активировать плазминоген также обладают бактериальные белки стрептокиназа и стафилокиназа, которые приобретают активность только после образования комплекса с Pgn или Pn. t-PA и стафилокиназа связываются с фибрином и, таким образом, избегают быстрой инактивации, тогда как стрептокиназа и u-PA не связываются с фибрином и могут активировать плазминоген как в циркулирующей крови, так и на поверхности сгустка, но сами быстро инактивируются [4].
Наличие двух активаторов фибринолиза поддерживает надежность осуществления своевременного лизиса тромба при образовании внутрисосудистых фибриновых сгустков. Различное строение каталитических центров молекул t-PA и u-PA и различные участки связывания на клеточной поверхности или компонентах внеклеточного матрикса обуславливают разную локализацию внеклеточного протеолиза в зависимости от того, какой из активаторов плазминогена экспрессируется в данной конкретной ситуации [6]. Также различие заключается в том, что t-PA способен инициировать лизис фибрина, а u-PA более эффективен при уже начавшемся фибринолизе. Каждый из активаторов приводит к изменению конформации плазминогена, т. е. они является синергистами [6].
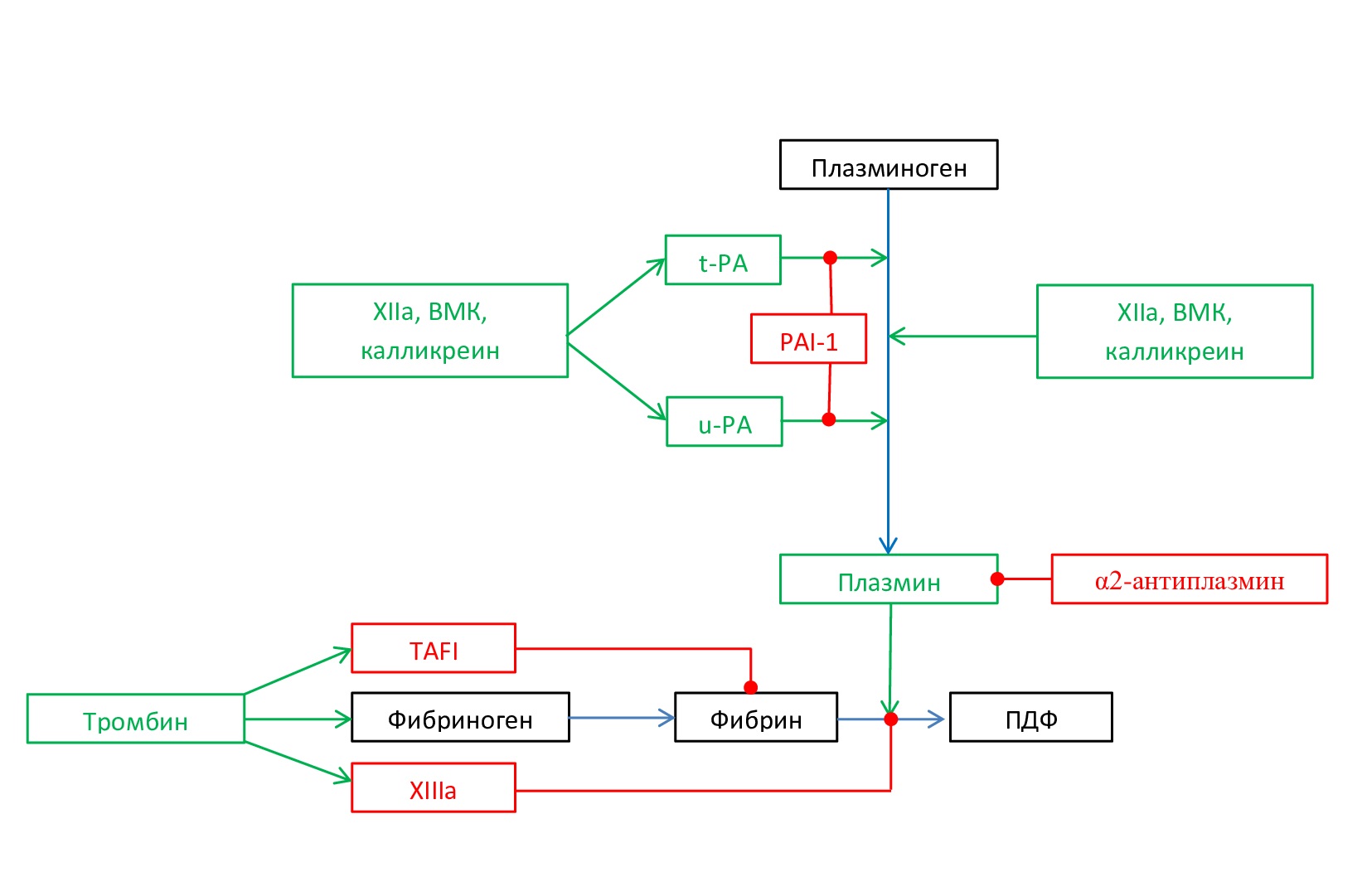
Рис. 4. Схема активации и торможения фибринолиза. Активация процесса – зеленые линии; торможение процесса – красные линии
Fig. 4. Scheme of activation and inhibition of fibrinolysis. Activation of the process – green lines; inhibition of the process – red lines
Активация Pgn, опосредованная t-PA, в первую очередь приводит к растворению фибрина в кровотоке, тогда как u-PA связывается со специфическим клеточным рецептором u-PA (u-PAR), что ведет к усилению активации связанного с клетками Pgn. Основная роль u-PA заключается в индукции перицеллюлярного протеолиза во время ремоделирования и восстановления тканей, овуляции, имплантации эмбриона и инвазии опухоли [7].
Является доказанным участие в активации фибринолиза фактора XIIа. Предполагают наличие двух механизмов такой активации. Первый механизм предполагает непосредственное действие фактора XIIа, калликреина и высокомолекулярного кининогена на Pgn (Хагеман-зависимый фибринолиз). Второй механизм – опосредованная активация Pgn через t-PA и u-PA (Хагеман-независимый фибринолиз) (рис. 4) [6].
Предполагают, что Хагеман-зависимый фибринолиз носит срочный характер и необходим для очистки сосудистого русла от нестабилизированного фибрина, который образуется в процессе внутрисосудистого свертывания крови [6].
Торможение фибринолиза
В результате гиперактивации плазминовой системы нарушается гемостаз и развивается геморрагический фибринолитический синдром. Клинически он проявляется тяжёлыми кровотечениями. Система ингибиторов фибринолиза предотвращает развитие этого синдрома.
Чрезмерная фибринолитическая активность тормозится несколькими механизмами: прямым ингибированием плазмина (α2-антиплазмин), ингибированием активаторов плазминогена (рlasminogen activator inhibitor-1 PAI-1 и рlasminogen activator inhibitor-2 – PAI-2), удалением на молекулах фибрина сайтов связывания плазмина и t-PA (активируемый тромбином ингибитор фибринолиза (thrombin-activatable fibrinolysis inhibitor – TAFI)) (рис.4).
Ингибиторы активатора плазминогена
Ингибиторы активатора плазминогена 1 и 2 (PAI-1 и PAI-2) снижают активность t-PA и u-PA. Основным ингибитором t-PA и u-PA является PAI-1. Его дефицит встречается у людей редко и, как правило, сопровождается длительными и отложенными кровотечениями [8]. PAI-1 инактивирует t-PA и u-PA, образуя с ними нераспадающийся комплекс. PAI-1 накапливается в фибриновых сгустках в концентрации, в 500 раз превышающий его уровень в плазме крови, предотвращая преждевременное рассасывание свежеобразованного тромба [6]. PAI-2 вырабатывается в основном плацентой, поэтому считается, что основное значение он имеет при беременности.
α2-антиплазмин
α2-антиплазмин (α2-АР) напрямую связывает и ингибирует плазмин. Процесс ингибирования фибринолиза под действием α2-АР осуществляется 3 путями:
- путем образования комплекса с плазмином;
- торможением адсорбции плазмина на фибрине;
- поперечного связывания с фибрином при действии фактора XIIIa, что делает фибриновый сгусток устойчивым к влиянию плазмина (фактор XIIIa присоединяет молекулы α2-антиплазмина к нитям фибрина, что ухудшает процесс лизиса) [4,9].
Активируемый тромбином ингибитор фибринолиза
Активируемый тромбином ингибитор фибринолиза (TAFI) отщепляет С-концевые остатки лизина от нитей фибрина и тем самым лишает плазминоген и t-PA участков связывания с фибрином [4].
Кроме перечисленных ферментов фибринолиз тормозят α1-антитрипсин, α2-макроглобулин, С1-инактиватор и др. (табл.).
Свойства фибринового сгустка
Эффективность фибринолиза зависит не только от активности ферментов, но и от свойств фибринового сгустка, таких как полнота поперечной сшивки под действием фактора XIIIa, плотность и толщина волокон, их разветвлённость, размер пор и т. д. Скорость фибринолиза существенно замедляется при наличии в составе фибринового тромба тромбоцитарных агрегатов или механической деформации тромба. Зависимость скорости фибринолиза от структуры и свойств сгустка или тромба определяется физическими факторами, такими как проницаемость для фибринолитических ферментов, площадь поверхности фибриновых волокон, скорость адсорбции и десорбции белков и др. [4].
Существует связь между структурой фибрина и риском сердечно-сосудистых событий. Многие исследования свидетельствуют о том, что тонкие волокна (образованные при высоких концентрациях тромбина) труднее растворить, чем толстые волокна, несмотря на более быстрый протеолиз отдельных тонких волокон. Предполагают, что Pn более эффективно действует на плотно упакованные мономеры в пределах одного фибринового сгустка, чем на рыхлый сгусток, где Pn должен диффундировать через поры фибирновой сети от нити к нити [10].
Таблица 1. Основные компоненты фибринолитической системы
Table 1. Main components of the fibrinolytic system
Фактор | Характеристика |
Фибриноген / фибрин | Структурно молекула фибриногена представлена в виде нескольких доменов: два D-домена, центральный E-домен и два фибринопептида (рис. 3). Активация фибриногена происходит путем отрезания тромбином фибринопептидов A и B. Сначала происходит отщепление фибринопептида А – этого достаточно для начала полимеризации, молекулы фибрина начинают образовывать полимерную нить. После отщепления фибринопептидов B нити фибрина получают возможность агрегировать латерально, образуя трехмерную фибриновую сеть. Параметры фибриновой сети (толщина фибрилл и расстояние между ветвлениями) зависят от условий полимеризации – pH среды, концентрации солей, концентрации тромбина. |
Плазминоген / плазмин | Pgn – это профермент, предшественник плазмина, расщепляющего фибрин. Синтезируется в основном в печени, а также в костном мозге и почках. Представляет собой одноцепочечный гликопротеин. Плазмин является сериновой протеазой. Превращение плазминогена в плазмин происходит под действием активаторов плазминогена, под влиянием которых образуется двухцепочечная молекула [6]. В молекуле Pn и Pgn есть участки, комплементарные доменам фибрина, и одна молекула Pn может связывать несколько молекул фибрина благодаря своей поливалентности. Это свойство позволяет плазмину действовать на новые интактные молекулы фибрина, оставаясь связанным со своим субстратом. Поливалентность означает, что плазмин может связываться с фибрином посредством нескольких фибринсвязывающих участков (крингл-доменов), которые взаимодействуют с фибрином через лизинсвязывющие участки. Из 5 крингл-доменов крингл-1 обеспечивает высокое сродство плазмина к фибрину, а крингл-5 – низкое, но он может взаимодействовать с частично деградированным фибрином, содержащим С-концевые остатки лизина. Кроме того, крингл-5 имеет наибольшее сродство к клеткам эндотелия, а это значит, что взаимодействие Pgn с эндотелиальными клетками происходит через этот крингл. Pn, обладая широкой субстатной специфичностью, способен расщеплять практически все белки плазмы. Он может гидролизовать протеогликаны межклеточного матрикса, в том числе фибронектин и ламинин, также он способен активировать некоторые протеазы и факторы роста. Активируя матриксные металлопротеазы, плазмин способствует перестройке (ремоделированию) межклеточного матрикса [6]. Благодаря способности плазмина расщеплять фибронектин и ламинин, он служит одним из важнейших факторов, обеспечивающих рост и метастазирование злокачественных опухолей. К Pn имеются рецепторы на различных клетках, в том числе на моноцитах, гранулоцитах, лимфоцитах, эндотелиоцитах и тромбоцитах. Таким образом, Pgn и Pn вовлечены, помимо фибринолиза, в целый ряд физиологических и патологических процессов, например, миграцию клеток, заживление ран, воспаление, атеросклероз, эмбриогенез, овуляцию, ангиогенез, опухолевый рост и метастазирование. |
Тканевый активатор плазминогена (t-PA, tissue plasminogen activator) | Сериновая протеаза. Секретируется эндотелием, моноцитами, мегакариоцитами уже в активном состоянии. t-PA секретируется в виде одноцепочечной формы. При взаимодействии с плазмином, калликреином и фактором Xа, которые расщепляют пептидную связь Арг275-Иле276, t-PA переходит в двухцепочечную форму. Такая двуцепочечная форма t-PA обладает большей активностью, чем одноцепочечная. В плазме t-PA циркулирует в концентрации 70 пМ, причем в свободной форме находится лишь 20 % этого количества, остальные молекулы t-PA находятся в связанном состоянии со своим ингибитором (PAI) [8]. Свободный t-PA и комплексы t-PA с ингибиторами быстро удаляются из кровотока, связываясь с рецепторами эндотелиальных клеток и гепатоцитов. Время полувыведения составляет в норме около 3 минут [8]. После взаимодействия с мембранами эндотелиальных клеток и белками межклеточного матрикса (тромбоспондином, желатином, коллагеном IV типа) такой связанный t-PA защищен от ингибирования PAI-I. t-PA имеет два активных центра: один связывается с фибрином, а другой каталитически активирует Pgn. Так как t-PA и Pgn обладают высокой тропностью к фибрину, то на поверхности фибрина образуется комплекс Pgn-t-PA-фибрин, в котором действие активатора Pgn проявляется наиболее интенсивно [6]. В отсутствии фибрина t-PA проявляет низкую активность по отношению к Pgn. В присутствии фибрина эта активность резко возрастает. Для высокоэффективной работы молекулы t-PA и Pgn должны быть фиксированы на одном сайте связывания фибриновых нитей. При этом фибрин выполняет двойную функцию: является кофактором активации Pgn и субстратом для образующегося Pn. В лизисе фибринового сгустка, вызванном t-PA, можно выделить две фазы. В первой, медленной фазе одноцепочечный t-PA активирует Pgn на неповрежденной поверхности фибрина. Во второй фазе фибрин частично разрушается Pn и обнажает дополнительные и, вероятно, другие (т. е. С-концевые, а не внутренние остатки лизина) сайты связывания для Pgn и, возможно, t-PA [7]. Возникающий под влиянием тромбина фибрин стимулирует синтез эндотелиоцитами простациклина и t-PA. Чем больше образуется фибрина, тем больше простациклина и t-PA секретируют эндотелиоциты. Данная реакция не только препятствует распространению тромба по сосуду, но и способствует его реканализации [6]. |
u-PA, урокиназа, urokinase plasminogen activator | Образуется в юкстагломерулярном аппарате почек, эндотелиоцитами, фибробластами, эпителиальными и другими клетками. Синтезируется в виде одноцепочечного предшественника про-u-PA, который после связывания со специфическими рецепторами на поверхности клеток превращается под действием Pn, трипсина, фактора XIIа, калликреина и ВМК в активную двухцепочечную молекулу. Связанный с рецептором u-PA не подвергается распаду и приобретает способность активировать Pgn. Урокиназа – многофункциональный мультидоменный белок, который стимулирует фибринолиз, ремоделирование внеклеточного матрикса, клеточную миграцию и пролиферацию, оказывает влияние на ремоделирование кровеносных сосудов и течение атеросклероза [6]. |
Фактор XII (фактор Хагемана) | Контактный фактор, активатор Pgn и прекалликреина, активируется в результате контакта с субэндотелием сосудов. XIIа протеолитически расщепляет прекалликреин, находящийся в комплексе с ВМК, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Участие в фибринолизе заключается в активации Pgn или непосредственно (Хагеман-зависимый фибринолиз) или опосредовано через активацию t-PA и u-PA (Хагеман-независимый фибринолиз). |
Прекалликреин (фактор Флетчера) | Контактный фактор, профермент калликреина, катализирующего образование кининов. Необходим для активации фактора XII. |
Высокомолекулярный кининоген (ВМК, фактор Фитцжеральда) | В кровотоке находится в комплексе с фактором XII, является рецептором прекалликреина. Необходим для активации фактора XII. |
Ингибитор активатора плазминогена 1-го типа (РАI-1, рlasminogen activator inhibitor-1) | Основной ингибитор фибринолиза. Является ингибитором сериновой протеазы. Белок специфично ингибирует эффект t-PA и u-РА, препятствуя их взаимодействию с плазминогеном. В свою очередь сам PAI-1 ингибируется протеином С. Таким образом, протеин С не только подавляет коагуляцию (через инактивацию факторов Va и VIIIа), но и усиливает фибринолиз. Также РАI-1 стимулирует хемотаксис и активность фагоцитов и ангиогенез. Синтезируется эндотелиоцитами, гепатоцитами, макрофагами, фибробластами и мышечными клетками [6]. Его продукция увеличивается под действием С-реактивного белка, особенно при гипергликемии. |
Ингибитор активатора плазминогена 2-го типа (РАI-2, рlasminogen activator inhibitor-2) | Вырабатывается плацентой, моноцитами, эозинофилами, кератиноцитами. Играет важную роль в торможении фибринолиза и развитии тромбоэмболических осложнений при беременности. РАI-2 является ингибитором активаторов плазминогена в тканях эпидермиса, пищевода, роговицы, языка и вагины. В норме РАI-2 в плазме не обнаруживается, появляясь лишь при беременности [8]. Его концентрация достигает максимума на 33-й неделе гестации – порядка 250 нг/мл. РАI-2 обнаруживают также у пациентов с миелобластным лейкозом типов М4 и М5 [8]. Покоящиеся эндотелиальные клетки содержат низкие концентрации РАI-2. Однако его синтез может быстро стимулироваться различными воспалительными медиаторами [11]. РАI-2 имеет как внеклеточные, так и внутриклеточные функции и действует как многофункциональный белок [11]: он может изменять экспрессию генов, модулировать скорость пролиферации и дифференцировки клеток и ингибировать апоптоз. |
α2-aнтиплазмин (α2-AP) | Сериновая протеаза – основной быстродействующий ингибитор плазмина. Он мешает Pgn адсорбироваться на фибрине, снижая количество образующегося Pn на поверхности сгустка и тем самым резко замедляя фибринолиз. Для специфического связывания α2-AP с фибриногеном необходимо присутствие фактора XIII. Также он образует комплекс с Pn (Pn-α2-AP), который может прикрепляться к фибрину и конкурировать с Pgn за связывание с C-концевым лизином. α2-AP не активен по отношению к адсорбированному на фибрине Pn. |
α1-антитрипсин (α1-протеазный ингибитор) | α1-антитрипсин – одноцепочечный гликопротеин, ингибитор протеаз семейства серпинов, преимущественной мишенью которого является нейтрофильная эластаза. Участие в фибринолизе заключается в инактивции Pn в кровотоке. Связанный с фибрином Pn этим ферменом не разрушается [6]. |
α2-макроглобулин | Является основным ингибитором широкого спектра протеиназ. Макроглобулин играет роль ловушки, захватывая протеолитические ферменты, вследствие чего к субстрату блокируется доступ извне. Образуется комплекс –α2-макроглобулин – протеаза, который затем переносится в печень. В системе гемостаза инактивирует тромбин, XIIа и Pn. Макроглобулин начинает оказывать заметный эффект на систему фибринолиза, когда истощаются запасы α2-АР, и роль основного ингибитора Pn переходит к макроглобулину, хотя его эффективность по отношению к Pn в 10 раз ниже, чем у α2-АР. Повышение концентрации α2-макроглобулина в крови наблюдается при заболеваниях, связанных с фиброзом печени (цирроз, гепатиты, болезнь Вильсона–Коновалова), нефротическом синдроме, аденоме простаты и сахарном диабете. |
С1-ингибитор (ингибитор эстеразы C1) | С1-ингибитор является белком острой фазы. Его синтез индуцируется в моноцитах, гепатоцитах и фибробластах интерфероном-γ, интерлейкином-6 и фактором некроза опухоли альфа. Ингибирует сериновые протеиназы, путем формирования плотного комплекса с целевой протеиназой. Его основными целевыми протеиназами являются белки системы комплемента C1r, C1s, факторы свертывания XIa, XIIa и калликреин и Pn [12,13]. |
Активируемый тромбином ингибитор фибринолиза (TAFI, thrombin-activatable fibrinolysis inhibitor, карбоксипептидаза Y),
| TAFI — одноцепочечный белок плазмы, вырабатывается печенью и мегакариоцитами. Активируется тромбином и Pn. Образовавшийся TAFIа препятствует связыванию фибрина с Pgn и t-PA. В результате происходит уменьшение образования Pn и торможение фибринолиза. TAFI удаляет С-концевой лизин, разрушая лизин-связывающий сайт фибрина, необходимый для фиксации t-PA и Pgn. В повышенной концентрации TAFI прямо ингибирует Pgn, что предотвращает преждевременный лизис тромба [14,15]. |
Патология фибринолиза
Процесс фибринолиза необходим для восстановления кровотока в поврежденном сосуде. При патологии он может быть избыточным (гиперфибринолиз) или недостаточным (гипофибринолиз), усугубляя кровотечение или тромбоз, и тем самым осложняя многие патологические состояния различной этиологии.
Гиперфибринолиз
Повышенную активацию фибринолитической системы, которая вызывает и/или усиливает кровоточивость, можно разделить на первичный и вторичный гиперфибринолиз.
Первичный гиперфибринолиз
При первичном гиперфибринолизе избыточная фибринолитическая активность развивается либо без всяких признаков, либо с минимальными проявлениями гиперкоагуляции или тромбоза. Поскольку первичный гиперфибринолиз развивается в отсутствие фибрина и сопровождается расщеплением фибриногена, его можно назвать «первичный фибриногенолиз» [4]. Первичный гиперфибринолиз может быть наследственным или приобретённым.
Первичный наследственный гиперфибринолиз
Наследственные нарушения свертываемости крови при первичном гиперфибринолизе включают дефицит α2-АР, дефицит РАI-1 и Квебекский тромбоцитарный синдром.
- Дефицит α2-антиплазмина (болезнь Миясото). Малоизученная патология, наследуется, вероятно, аутосомно-рецессивно. Поскольку α2-AP является ингибитором Pn, то дефицит этого фермента может привести к его избыточному образованию и, следовательно, привести к гиперфибринолизу и кровотечению. Распространенность дефицита α2-AP неизвестна, но он встречается очень редко, характеризуется клиническим кровотечением из-за преждевременного растворения гемостатических пробок, обычно проявляющимся в виде повторного кровотечения после травмы или инвазивных/хирургических процедур [15,16] (рис. 5).
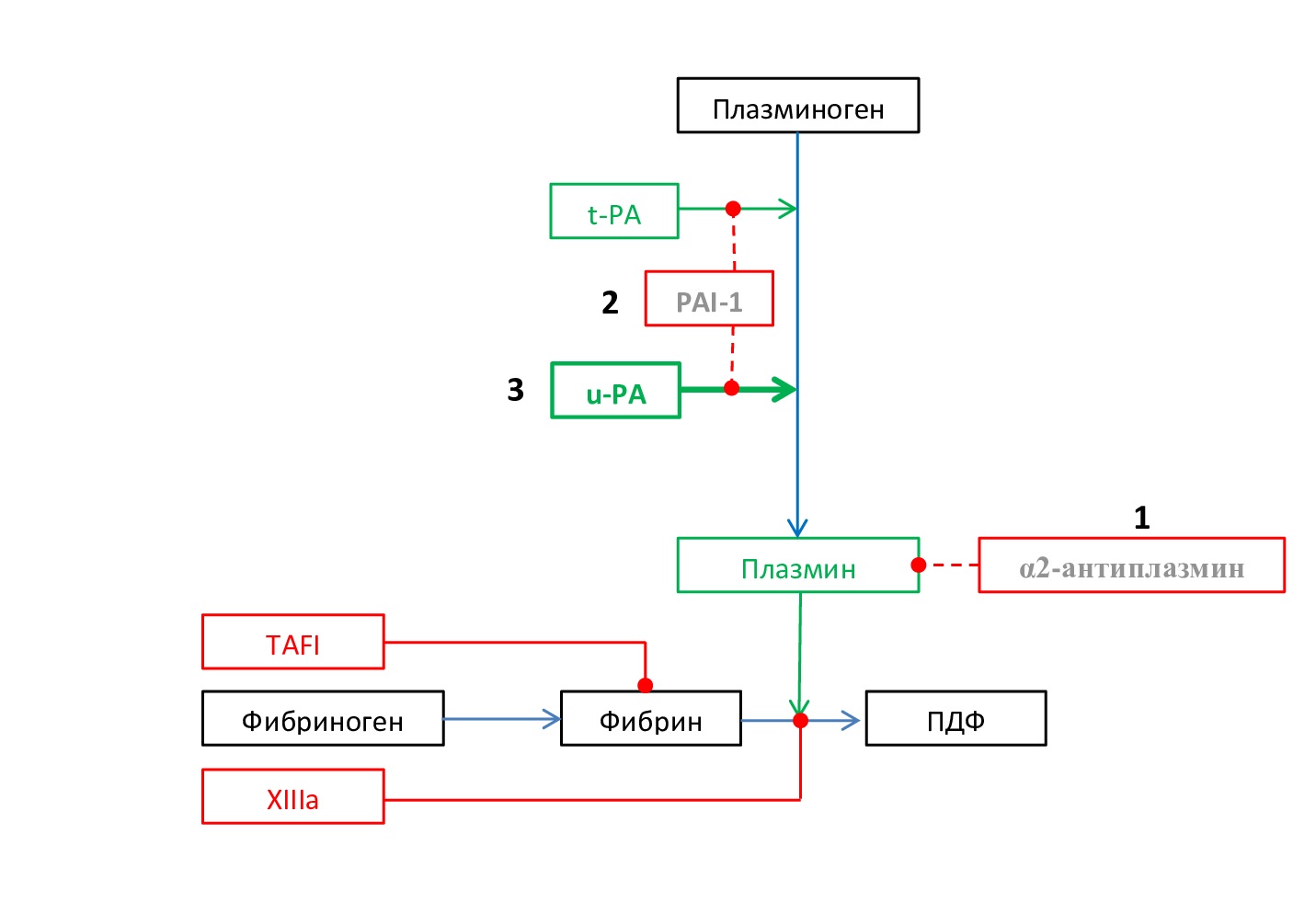
Рис. 5. Схема развития основных механизмов первичного гиперфибринолиза: 1 – дефицит α2-антиплазмина, 2 – дефицит PAI-1, 3 – Квебекский тромбоцитарный синдром
Fig. 5. Scheme of development of the main mechanisms of primary hyperfibrinolysis: 1 – α2-antiplasmin deficiency, 2 – PAI-1 deficiency, 3 – Quebec platelet syndrome
- Дефицит ингибитора активатора плазминогена-1. PAI-1 является основным ингибитором t-PA и u-PA. Врожденный дефицит PAI-1, передаваемый как аутосомно-рецессивный признак, может быть количественным (снижение синтеза) или качественным (синтез патологического PAI-1). Врожденный дефицит PAI-1 является чрезвычайно редким нарушением свертываемости крови. В то время как у гетерозигот обычно нет проявлений кровотечения, дефицит PAI-1 у гомозигот, по-видимому, проявляется легким или умеренным нарушением свертываемости крови. У этих пациентов редко бывают спонтанные кровотечения, аномальные кровотечения возникают только после травмы или операции. Склонность к кровотечениям из-за врожденного дефицита PAI-1 также проявляется в младенчестве и у детей. У женщин с дефицитом PAI-1 были зарегистрированы меноррагии и акушерские осложнения (выкидыши и преждевременные роды) (рис. 5) [16, 17].
- Квебекский тромбоцитарный синдром – редкое аутосомно-доминантное нарушение свертываемости крови, связанное с умеренным снижением количества тромбоцитов и сверхэкспрессией u-PA и его повышенным хранением в α-гранулах тромбоцитов, что приводит повышенному высвобождению u-PA и гиперфибринолизу. У пациентов с синдромом Квебека обычно наблюдается длительное кровотечение после травмы или хирургических и стоматологических процедур, но также могут наблюдаться легкие синяки, носовое кровотечение, гематурия, меноррагия и кровотечения из суставов (рис. 5) [16, 17].
Приобретенный первичный гиперфибринолиз
Чаще в клинической практике встречается приобретенный первичный гиперфибринолиз и его механизмы во многом определяются патогенезом основного заболевания. Чаще всего данное нарушение формируется при следующих патологиях.
- Цирроз печени. В терминальной стадии цирроза печени, которая часто сопровождается кровоточивостью, фибринолитическая система активирована за счёт усиленного высвобождения t-PA из эндотелиальных клеток и нарушения его печёночного клиренса, снижения активности TAFIa, подавления синтеза α2-AP и PAI-1. При пересадке печени фоновый гиперфибринолиз, сопровождающий хроническое заболевание печени, ещё более усиливается за счёт высокой концентрации t-PA, который высвобождается из эндотелия трансплантата в результате гипоксии и ацидоза (рис. 6) [18,19].
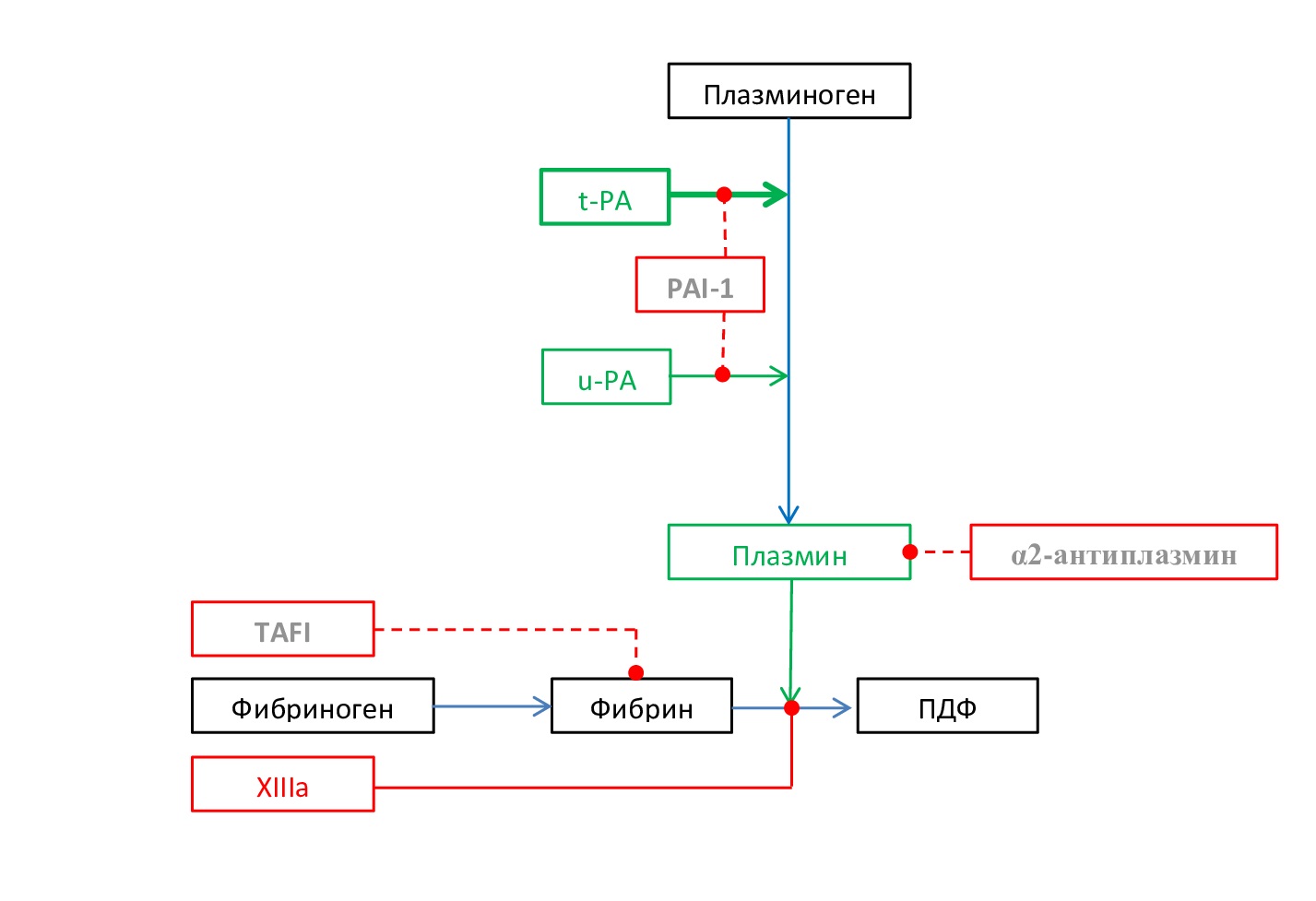
Рис. 6. Схема основных звеньев развития гиперфибринолиза при циррозе печени. Серым цветом выделены угнетенные звенья фибринолиза, жирным шрифтом выделено чрезмерно активированное звено фибринолиза
Fig. 6. Scheme of the main links in the development of hyperfibrinolysis in liver cirrhosis. The suppressed links of fibrinolysis are highlighted in gray, the excessively activated link of fibrinolysis is highlighted in bold
- Острый промиелоцитарный лейкоз. У пациентов с острым промиелоцитарным лейкозом формируется тяжелый геморрагический диатез. Лейкемические клетки экспрессируют много аннексина II. Аннексин II является профибринолитическим корецептором для плазминогена и t-PA на поверхности эндотелиальных клеток и способствует образованию плазмина. Этот механизм обусловливает усиленное образование активного плазмина, локализованного на клеточной поверхности и потому защищённого от ингибиторов, который усугубляет гиперфибринолиз независимо от синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) [16,19,20].
- Опухоли предстательной железы. У пациентов с аденомой предстательной железы, которые перенесли аденомэктомию, послеоперационное кровотечение связано с локальным повышением фибринолитической активности за счёт u-PA, который в большом количестве вырабатывается клетками простаты. При раке предстательной железы послеоперационная кровоточивость сочетается с повышенным уровнем u-PA в крови (рис. 7) [4].
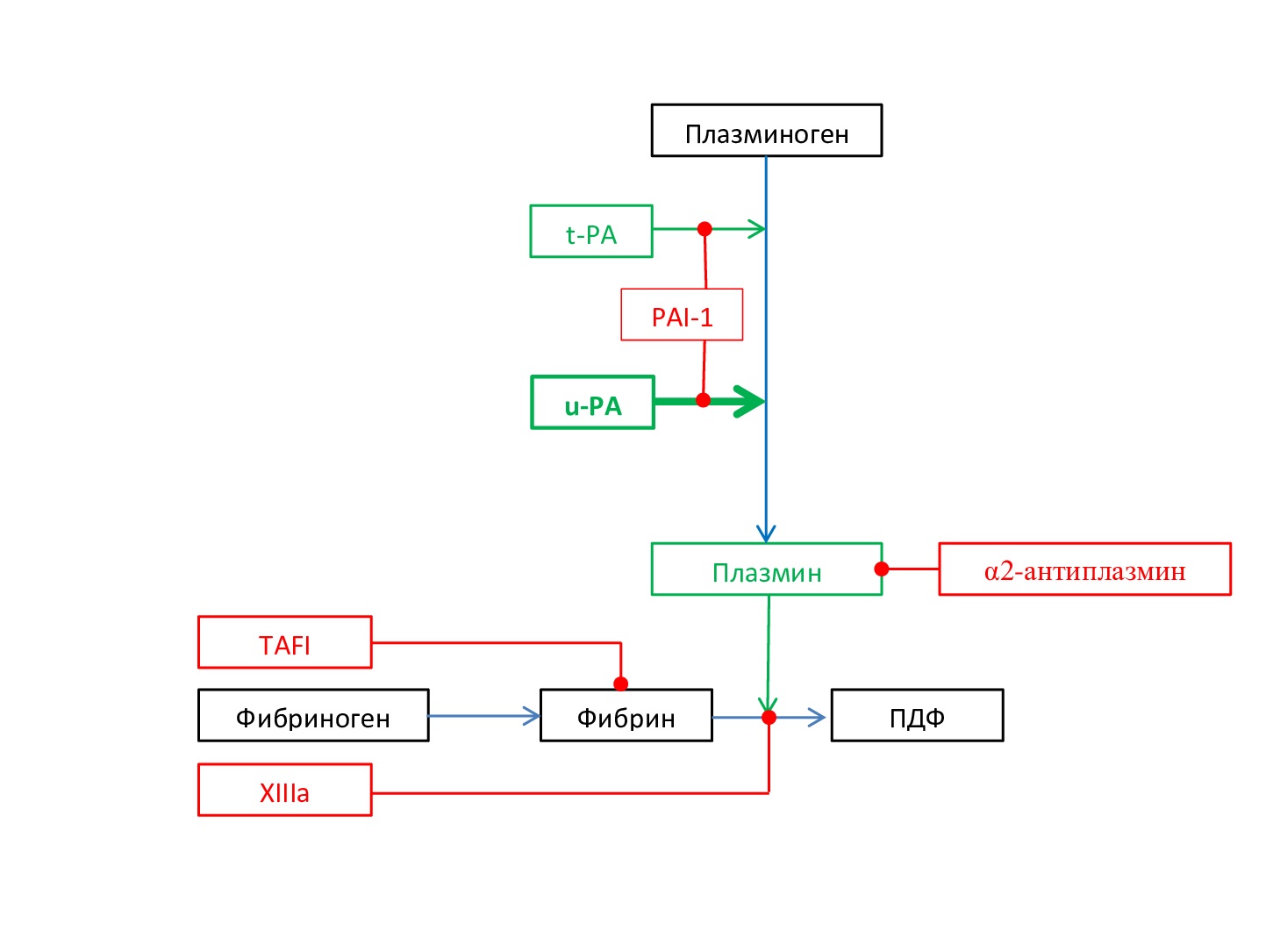
Рис 7. Схема основных звеньев развития гиперфибринолиза при опухолях предстательной железы
Fig. 7. Scheme of the main links in the development of hyperfibrinolysis in prostate tumors
Системный и локальный первичный гиперфибринолиз вносит существенный вклад в меноррагии различной этиологии, которые поддаются лечению антифибринолитическими препаратами.
Вторичный гиперфибринолиз
В основе вторичного гиперфибринолиза лежит повышенная активность фибринолитической системы на фоне активации коагуляционного гемостаза и образования тромбина. Компоненты фибринолитической системы имеют нормальную структуру, доступность и функцию, но при этом фибрина образуется либо недостаточно, либо он имеет дефектную структуру, либо фибринолиз чрезмерно активируется при системной гиперкоагуляции.
Вторичный гиперфибринолиз может быть наследственным и приобретенным [20].
Вторичный наследственный гиперфибринолиз
- Гемофилии. Гемофилия A, B и C — это редкие врожденные состояния, развивающиеся при дефиците факторов свертывания крови VIII, IX и XI соответственно. Дефицит этих факторов не оказывает влияние на формирование тромбина в фазу инициации, но тормозит образование тромбина в фазу распространения свертывания крови. Таким образом, определенное количество фибрина образуется во время свертывания цельной гемофильной крови, что позволяет предположить, что кровотечение вызвано скорее нестабильностью фибринового сгустка, а не дефицитом фибрина. Фибрин, образующийся в гемофильной плазме, имеет более толстые волокна, большие поры, более низкую плотность и повышенную проницаемость по сравнению с нормальным фибрином. Эти структурные особенности гемофильных сгустков увеличивают их восприимчивость к действию t-PA за счет повышенной проницаемости активатора в фибриновый сгусток, более высокой активации фибрином Pgn и более эффективной работы Pn. Низкие уровни тромбина при гемофилии приводят к задержке активации TAFI, тем самым способствуя нестабильности гемофильных сгустков из-за снижения регуляции существенного механизма отрицательной обратной связи. Также сниженная скорость образования тромбина при гемофилии задерживает активацию плазменного фактора XIII, что усугубляет нестабильность сгустка (рис. 8) [20].
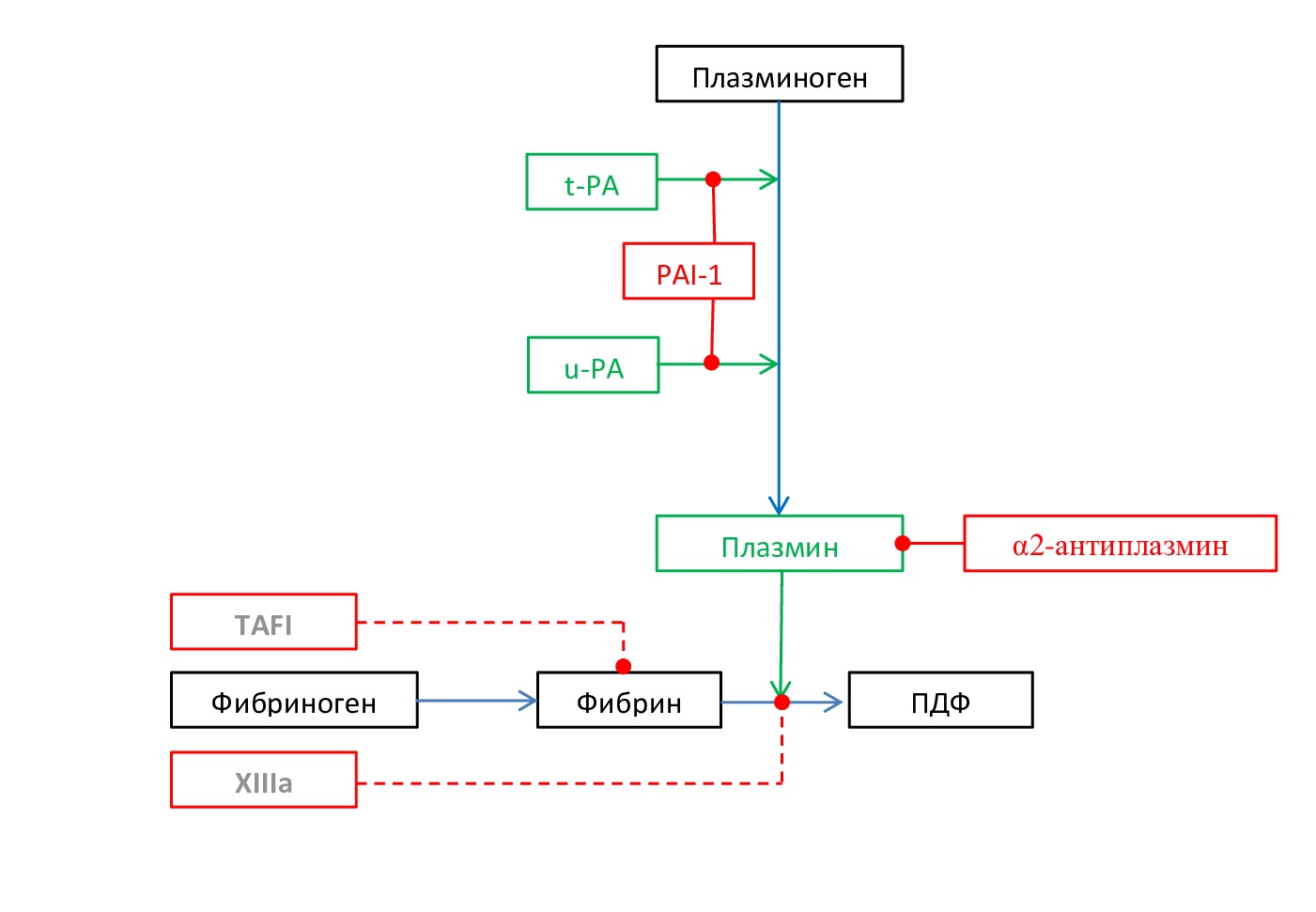
Рис. 8. Схема нарушения фибринолиза при гемофилиях. Серым цветом выделены угнетенные звенья фибринолиза
Fig. 8. Scheme of fibrinolysis disorder in hemophilia. Inhibited fibrinolysis links are highlighted in gray
- Дефицит фактора XIII. Редкий геморрагический синдром, вызванный дефицитом или низкой активностью плазменного фактора XIII. При отсутствии фактора XIII нарушается формирование ковалентных связей в фибриновом сгустке между фибриновыми нитями и фибрин становится более чувствителен к действию плазмина. Может быть наследственным и приобретенным. Наследственная форма встречается очень редко – составляет около 1–2 случая на 1000000 [22]. Самым ранним клиническим проявлением врожденного дефицита фактора XIII является отсроченное пупочное кровотечение, возможны рецидивирующие подкожные и внутримышечные гематомы. Незначительные травмы могут спровоцировать опасное для жизни внутричерепное кровотечение [20].
Вторичный приобретенный гиперфибринолиз
- Диссеминированное внутрисосудистое свертывание крови. ДВС-синдром является распространенным тяжелым осложнением системной инфекции (при сепсисе), обширного разрушения тканей (при серьезной травме) и других состояниях. Гиперфибринолиз развивается в ответ на внутрисосудистую гиперактивацию системы свёртывания крови. Компенсаторная фибринолитическая реакция пропорциональна обширности отложения фибрина в сосудистом русле. Количество тканевого фактора в крови зависят от объема повреждения тканей и степени экспрессии тканевого фактора клетками. Все основные антикоагулянты, такие как антитромбин III, система протеина С, ингибитор пути тканевого фактора, оказываются истощёнными из-за потребления, сниженного синтеза и протеолитического разрушения. Продолжающаяся массивная и диффузная активация системы свёртывания крови ведёт к истощению прокоагулянтов и тромбоцитов, которое вызывает тяжёлое кровотечение, известное как коагулопатия потребления. Гиперфибринолиз усугубляет кровоточивость при ДВС путём расщепления фибрина и фибриногена с образованием продуктов их деградации. Фибринолитический потенциал при ДВС определяется главным образом относительной концентрацией в крови t-PA и PAI-1, причём содержание обоих белков существенно возрастает вследствие усиленной секреции и высвобождения из активированных и/или разрушенных клеток сосудистого эндотелия и тромбоцитов. После преходящей гиперфибринолитической реакции фибринолитическая система при ДВС-синдроме истощается, и наступает гипофибринолиз, который усугубляет отложение фибрина, если условия для внутрисосудистого свёртывания крови сохраняются [4,20]. После травмы из-за массивной генерации тромбина и его комплексообразования с тромбомодулином на поверхности эндотелия заметно усиливается активация протеина C. Избыток активированного протеина C, в свою очередь, ингибирует высвобождение PAI-1 и приводит к повышению концентрации t-PA [19]. Дисбаланс t-PA и его ингибитора приводит к раннему гиперфибринолизу у пациентов с серьезным травматическим повреждением [19].
- Послеродовое кровотечение. Послеродовое кровотечение –основная причина материнской смертности во всем мире, обычно определяется как потеря 500 мл или более крови в течение 24 часов и характеризуется ранним началом гиперфибринолиза. Предполагают, что основным звеном патогенеза является повышенная активация протеина C, приводящая к ингибированию PAI-1 (протеин C активируется большим количеством тромбина). Торможение высвобождения PAI-1 способствует повышению концентрации t-PA [19,22].
- Тромболитическая терапия (ятрогенный гиперфибринолиз). Тромболитические (фибринолитические) фармакологические препараты нашли широкое применение в медицине при нарушениях центрального и периферического кровообращения. Принцип их действия заключается в том, что они активируют физиологическую систему фибринолиза (рис. 9).
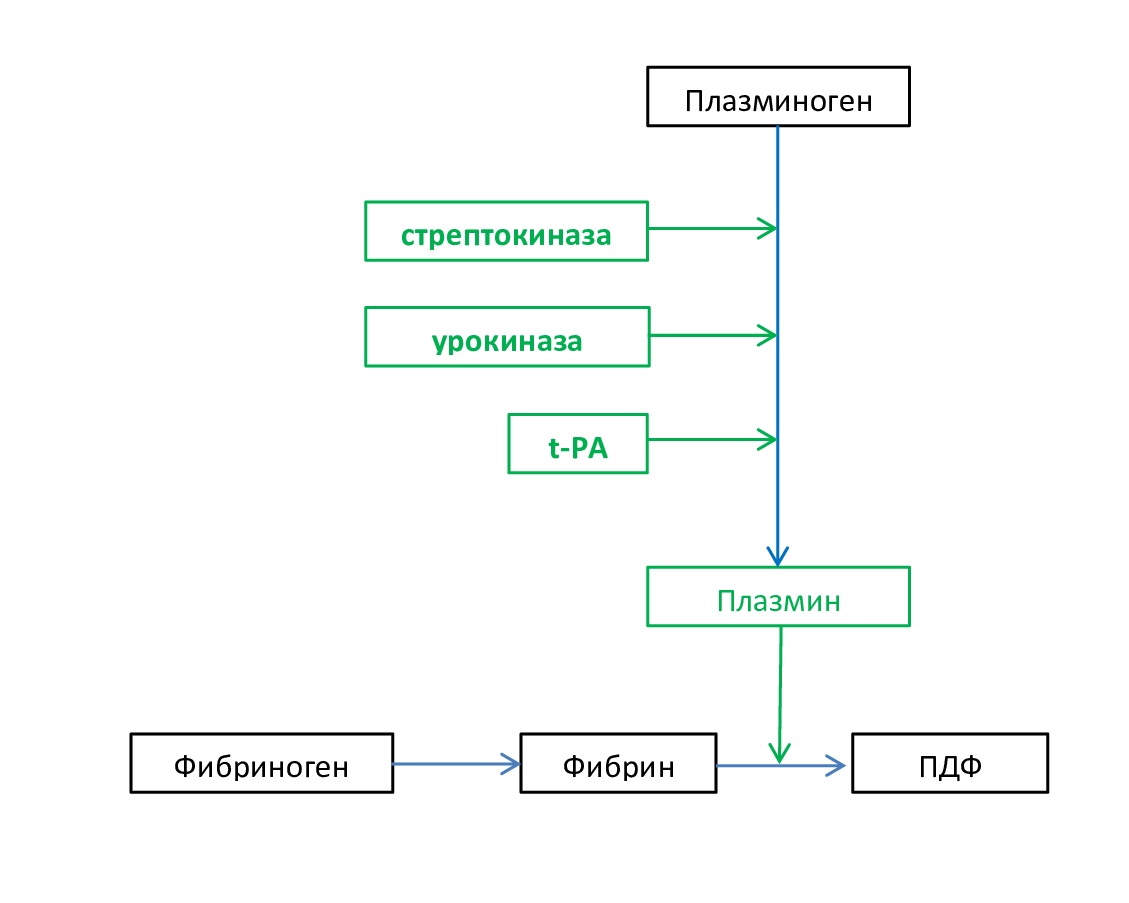
Рис. 9. Схема действия на фибринолиз основных фибринолитических лекарственных препаратов
Fig. 9. Scheme of action on fibrinolysis of the main fibrinolytic drugs
Одним из широко применяемых фибринолитических средств является стрептокиназа, которую продуцируют β-гемолитические стрептококки группы С. Стрептокиназа эффективна при свежих тромбах (примерно до 3 суток). Чем раньше начато лечение, тем благоприятнее результат. На основе стрептокиназы был создан препарат анистреплаза (эминаза) – нековалентный комплекс стрептокиназы с модифицированным Pgn. Является пролекарством: в организме происходит его деацетилирование и активация Pgn.
Эффективным фибринолитиком прямого действия является урокиназа. В настоящее время препарат производят методом генной инженерии или получают из культуры эмбриональных клеток почек человека.
Новым типом фибринолитиков является алтеплаза (актилизе), которую получают методом генной инженерии. Это рекомбинантный человеческий тканевый активатор плазминогена [20,23,24].
Гипофибринолиз
Гипофибринолиз представляет собой состояние, характеризующееся снижением активности фибринолитической системы организма, что ведет к замедлению растворения тромбов и повышенной склонности к тромбообразованию. Следует отметить, что поскольку система коагуляции – механизм сложный, многоуровневый и многокомпонентный, включающий разнонаправленно действующие ферменты, активаторы, ингибиторы, то повышенное тромбообразование является проявлением нарушения не только фибринолиза, но и других звеньев гемостаза. И часто при тромбофилии нарушения формируются на всех этапах формирования и разрушения тромба. Можно выделить первичный и вторичный гипофибринолиз.
Первичный гипофибринолиз
Основные механизмы нарушений фибринолиза включают наследственный дефицит и дисфункцию Pgn, повышенный уровень PAI-1 и α2-AP, нарушение выброса t-PA или u-PA, а также высокий уровень TAFIa (рис. 10). Кроме того, задержка фибринолиза коррелирует с аномальной структурой и повышенной механической прочностью фибриновых сгустков [4]. Примером первичного гипофибринолиза является синдром дефицита Pgn (гипоплазминемия) [25].
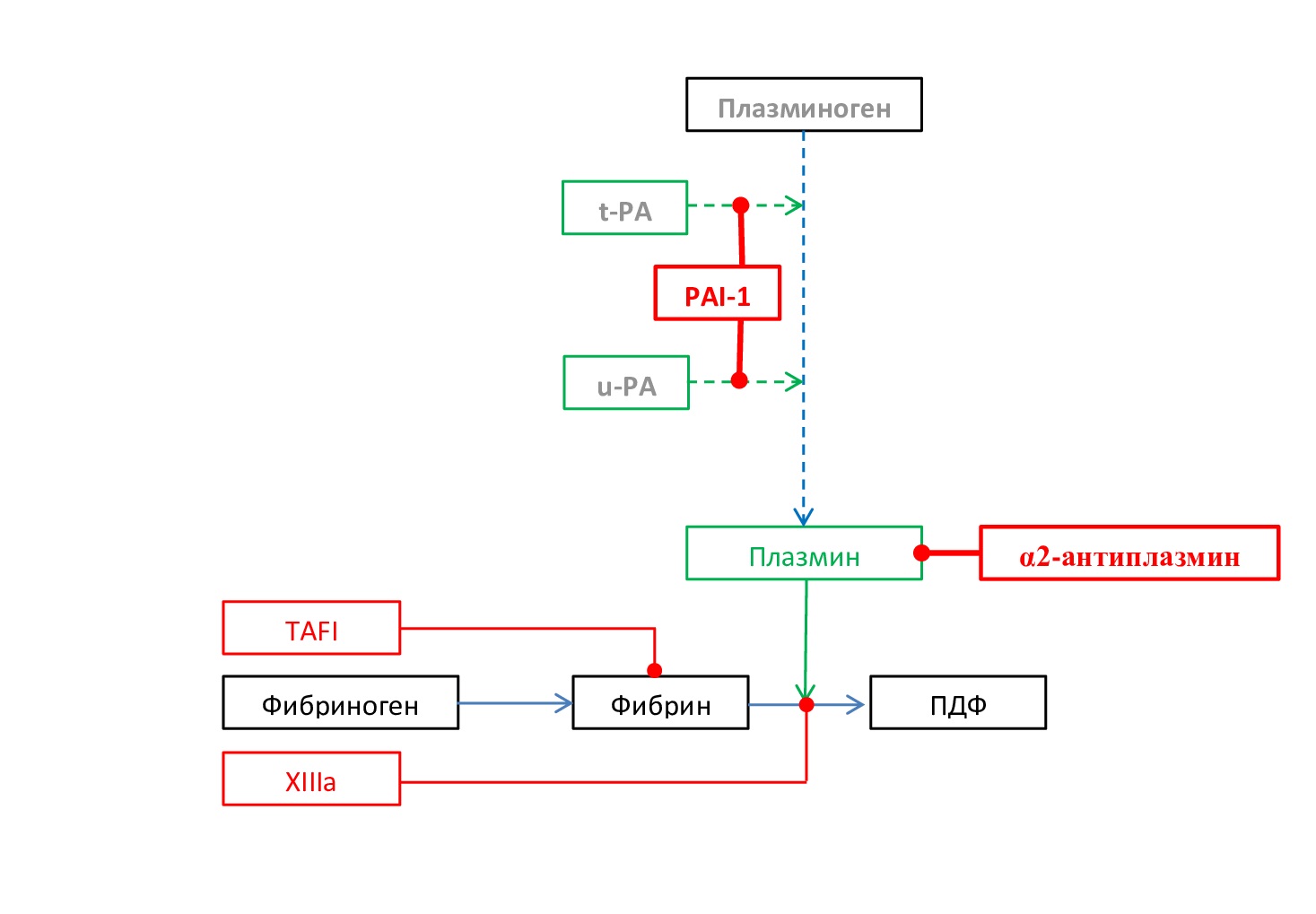
Рис. 10. Схема нарушения основных звеньев фибринолиза при первичном гипофибринолизе. Серым цветом выделены угнетенные звенья фибринолиза, жирным шрифтом выделено чрезмерно активированное звено фибринолиза
Fig. 10. Scheme of disruption of the main links of fibrinolysis in primary hypofibrinolysis. Inhibited links of fibrinolysis are highlighted in gray, excessively activated link of fibrinolysis is highlighted in bold
Вторичный гипофибринолиз
Возникает вследствие приобретенных состояний и заболеваний, таких как злокачественные новообразования, аутоиммунные заболевания, тяжелые инфекции, эндокринопатии (например, сахарный диабет), сердечно-сосудистые заболевания (например, тромбоз глубоких вен). При этих состояниях наблюдается повышенный уровень PAI-1 или уменьшение высвобождения t-PA. Также нарушенное высвобождение t-PA из сосудов происходит при гипертонии, курении, ожирении и заболевании почек [26]. Диабет, ожирение, воспалительные заболевания кишечника связаны с высокими уровнями PAI-1 и риском тромбоза. Глубокое подавление фибринолиза происходит на поздних стадиях ДВС-синдрома, когда на пике активации системы свёртывания крови фибринолиз подавлен из-за стойкого повышения уровня PAI-1. Если ДВС-синдром развивается вследствие сепсиса, фибринолиз угнетён за счёт образования комплексов Pn-α2-AP и блокады активаторов плазминогена PAI-1, который высвобождается из эндотелиальных клеток и тромбоцитов в ответ на стимуляцию эндотоксином и фактором некроза опухли альфа. Подавление фибринолиза при сепсисе усугубляется также индуцированной тромбином системной активацией TAFI [4].
Тесты оценки фибринолитической системы
Наиболее распространённые тесты исследования фибринолиза: время лизиса эуглобулиновых сгустков и его модификации, тромбоэластография и тромбоэластометрия, определение D-димера, концентрации фибриногена, продуктов деградации фибрина/фибриногена под действием Pn, активности α2-AP, PAI-1, Pgn, t-PA, u-PA, плазмин-антиплазминовые комплексов (Pn-α2-AP) и TAFI [27,28]. При этом, измерение активности отдельных компонентов фибринолитических параметров отражает лишь потенциальный уровень активности системы. Для оценки совокупной работы системы фибринолиза используют глобальные тесты [9].
Тесты оценки активности факторов фибринолиза
Плазминоген
Снижение функциональной активности Pgn в крови наблюдается у некоторых этнических групп, но связи с повышенным риском тромбоза не выявлено. Даже в случае гомозиготной недостаточности Pgn, у таких людей тромботические патологии не наблюдаются. Отсутствие тромботических патологий у таких пациентов, вероятно, вызвано тем, что даже остаточные концентрации Pgn (от 4 до 51 %) достаточны для нормальной работы системы фибринолиза [9].
На результаты исследования влияют лекарственные препараты – ингибиторы протеолиза (например, контрикал). Также на результатах теста может отразиться прием эстрогенсодержащих препаратов, стимулирующих синтез белков, в т. ч. Pgn в печени [29].
Абсолютное снижение Pgn почти всегда связано с его гиперпотреблением в результате активации фибринолиза, сопровождающей ДВС-синдром, массивные или длительные тромбозы, тромбоэмболии, инфаркт миокарда и медикаментозный тромболизис [29].
Врожденное снижение концентрации плазминогена часто сочетается с его функциональной неполноценностью и проявляется тромбофилией. Приобретенная гипоплазминогенемия может развиться при тяжелой патологии печени и почек. Гиперплазминогенемия наблюдается к концу беременности, при некоторых инфекционных, воспалительных процессах, опухолях, травмах [9,29].
Тканевый активатор плазминогена
Потеря активности t-PA происходит при связывании с избытком ингибитора плазминогена (PAI-1).
Уровень t-PA увеличивается с возрастом, после физических нагрузок и стрессов. Возрастание концентрации t-PA наблюдается при остром инфаркте миокарда, инсульте, заболеваниях печени, сепсисе и др. Снижение уровня t-PA может сформироваться при тромбозах глубоких вен, ишемическом инсульте, некоторых злокачественных новообразованиях и тяжелом сепсисе.
Ингибитор активатора плазминогена
Синтез PAI-1 значительно увеличивается при повреждении эндотелия, что приводит к замене антикоагулянтного потенциала эндотелия на прокоагулянтный.
PAI-1 – белок острой фазы, его концентрация в плазме возрастает вместе с интерлейкином-1. Повышенный уровень PAI-1 формируется после травм и операций, при венозных тромбозах, воспалении, инфекционных процессах и сепсисе, злокачественных опухолях, ожирении, болезнях печени, инфаркте миокарда и коронарных заболеваниях, а также при лечении глюкокортикоидами.
TAFI
Повышение концентрации TAFI в плазме коррелирует с вероятностью венозной тромбоэмболии – концентрация TAFI выше 90 перцентиля соответствует двукратному увеличению риска тромбоза глубоких вен нижних конечностей. Содержание в крови TAFI изменяется при печеночной и почечной недостаточности, некоторых эндокринных заболеваниях, беременности. Как и для остальных тестов фибринолитических факторов, информативность таких исследований довольна низка, так как она отражает лишь потенциальный уровень активности системы [9].
D-димер
D-димер является продуктом деградации фибрина. Он косвенно отражает результат совместной работы систем свертывания и фибринолиза. Низкая концентрация D-димера соответствует нормальному состоянию.
Повышение концентрации D-димера часто наблюдается при ДВС –синдроме (начиная с ранних стадий), артериальных и венозных тромбозах, тромбоэмболии легочной артерии, после травм и хирургических операций, у пожилых и при широком спектре воспалительных и онкологических состояний.
Возможен некоторый рост D-димера при беременности, сахарном диабете, длительной иммобилизации, в пожилом возрасте и др.
Данный тест показывает ложноположительные результаты при гипербилирубинемии, липемии, гемолизе и повышенном уровне ревматоидных факторов.
Глобальные фибринолитические тесты
Как было сказано выше, измерение активности отдельных фибринолитических параметров отражает лишь потенциальный уровень активности системы. Для совокупной оценки состояния системы фибринолиза используются глобальные тесты.
XIIа-калликреинзависимый фибринолиз (XIIа-зависимый лизис эуглобулинов)
Замедление XIIа-зависимого лизиса эуглобулинов (увеличение времени фибринолиза) наблюдается вследствие снижения уровня или недостаточной активации участвующих в реакции компонентов (фактора XIIа, прекалликреина, ВМК, Pgn). Чаще всего удлинение времени лизиса связано с дефицитом Pgn, присутствием большого количества ингибиторов протеолиза, с гиперфибриногенемией.
Тромбоэластография (ТЭГ)
Тромбоэластография – графическая регистрация спонтанного свертывания венозной крови с помощью тромбоэластографа [9]. Метод базируется на принципе изменения вязкости образца вследствие полимеризации фибрина.
ТЭГ измеряет скорость образования и разрушения фибринового сгустка и позволяет фиксировать гиперфибринолитические состояния. Используется для контроля гемостаза и корректировки антифибринолитической терапии при трансплантациях печени, кардиологических операциях с экстракорпоральным кровообращением, а также при травматических коагулопатиях.
Время лизиса сгустка
Время лизиса сгустка определяется как промежуток времени между моментом образования сгустка и полулизиса сгустка [9]. К плюсам метода можно отнести простоту постановки, возможность использования замороженных образцов, комплексное измерение фибринолиза с участием многих компонентов процесса. Тест времени лизиса сгустка чувствителен к уровню Pgn, α2-АР, PAI-1, TAFI, в то время как фибриноген, протромбин, факторы VII, X, XI слабо влияют на показания теста. Минусы метода: концентрация добавленного t-PA значительно выше физиологических значений; отсутствуют тромбоциты. Сниженный фибринолитический потенциал, проявляющийся в удлинении времени лизиса сгустка, – фактор риска венозной тромбоэмболии, артериального тромбоза, преэклампсии и других заболеваний.
Геморрагические и тромботические проявления характерны для широкого спектра как наследственных, так и приобретенных заболеваний. Чаще они обусловлены патологией тромбоцитарно-сосудистого и коагуляционного гемостаза. Но не стоит забывать и о том, что эти нарушения могут быть результатом дисфункции фибринолиза и антифибринолиза.
Заключение. Нарушения фибринолиза, связанные с нарушением естественного процесса растворения тромбов в организме, могут существенно влиять на развитие различных заболеваний. Снижение фибринолитической активности является фактором риска образования тромбов в венах, что может привести к тромбозу глубоких вен и тромбоэмболии легочной артерии [30]. Нарушение фибринолиза повышает риск развития инфаркта миокарда, усугубляя тяжесть уже имеющейся ИБС [31] и инсульта, способствуя образованию тромбов в кровеносных сосудах головного мозга [32]. Тяжелые инфекции могут спровоцировать системную воспалительную реакцию, которая влияет на фибринолиз, что может привести как к тромботическим, так и к геморрагическим осложнениям [33]. Синдром инсулинорезистентности, характеризующийся ожирением, изменением толерантности к глюкозе и нарушениями липидного обмена, связан с дефектами фибринолиза и повышенным риском тромбоза [34]. Заболевания печени и почек также оказывают большое влияние на течение фибринолиза и могут способствовать развитию кровотечения или тромботическим осложнениям [35,36].
Это неполный перечень заболеваний, патогенез которых тесно связан с нарушением системы гемостаза и фибринолиза в частности. Понимание физиологических и патологических механизмов этой подсистемы расширит представление практикующих врачей многих специальностей о работе системы гемостаза как единого целого и будет способствовать более точной диагностике и подбору специфического лечения у пациентов с кровоточивостью и тромбозами.
Список литературы
1. Сhapin J.C, Hajjar K.A. Fibrinolysis and the control of blood coagulation. Blood Rev. 2015;29(1):17-24 https://doi.org/10.1016/j.blre.2014.09.003
2. Nesheim M, Fredenburgh JC, Larsen GR. The dissociation constants and stoichiometries of the interactions of Lys-plasminogen and chloromethyl ketone derivatives of tissue plasminogen activator and the variant delta FEIX with intact fibrin. J Biol Chem. 1990 Dec 15;265(35):21541-8. https://doi.org/10.1016/S0021-9258(18)45774-2
3. Hva C.L, Larsen J.B. The Fibrinolytic System and Its Measurement: History, Current Uses and Future Directions for Diagnosis and Treatment. Int. J. Mol. Sci. 2023;24(18):14179. https://doi.org/10.3390/ijms241814179
4. Литвинов Р.И. Молекулярные механизмы и клиническое значение фибринолиза. Казанский медицинский журнал. 2013;4(5):711-718 [Litvinov R.I. Molecular mechanisms and clinical significance of fibrinolysis. Kazan Medical Journal. 2013;4(5):711-718 (In Russ.)] https://doi.org/10.17816/KMJ1926
5. Marinho D.S. Perioperative hyperfibrinolysis – physiology and pathophysiology. Braz J Anesthesiol. 2021;71(1):65-75. https://doi.org/ 10.1016/j.bjane.2020.12.007
6. Longstaff C, Kolev K. Basic mechanisms and regulation of fibrinolysis. J Thromb Haemost. 2015 Jun;13 Suppl 1:S98-105. doi: 10.1111/jth.12935
7. Rijken D.C., Lijnen H.R. New insights into the molecular mechanisms of the fibrinolytic system. Journal of Thrombosis and Haemostasis. 2009;7(1):4-13. https://doi.org/10.1111/j.1538-7836.2008.03220.x
8. Жалялов А.С., Баландина А.Н., Купраш А.Д. и др. Современные представления о системе фибринолиза и методах диагностики ее нарушений. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017;16(1):69-82 [Zhalyalov A.S., Balandina A.N., Kuprash A.D. et al. Modern concepts of the fibrinolysis system and methods for diagnosing its disorders. Issues of hematology/oncology and immunopathology in pediatrics. 2017, 16(1);69-82 (In Russ.)] https://doi.org/10.24287/1726-1708-2017-16-1-69-82
9. Hur WS, Mazinani N, Lu XJ, Britton HM, Byrnes JR, Wolberg AS, Kastrup CJ. Coagulation factor XIIIa is inactivated by plasmin. Blood. 2015 Nov 12;126(20):2329-37. doi: 10.1182/blood-2015-07-650713
10. Longstaff J.C., Kolev K. Basic mechanisms and regulation of fibrinolysis. Journal of Thrombosis and Haemostasis. 2015;13(1):98-105. https://doi.org/10.1111/jth.12935
11. Boncela J., Przygodzka P., Papiewska-Pajak I. et al. Association of plasminogen activator inhibitor type 2 (PAI-2) with proteasome within endothelial cells activated with inflammatory stimuli. J Biol Chem. 2011;286(50):43164-43171. https://doi.org/10.1074/jbc.M111.245647
12. Zahedi R., Davis III A.E. C1 inhibitor: C1 esterase inhibitor, C1 inactivator. The Complement FactsBook. 2000:206-209. https://doi.org/10.1016/B978-012733360-1/50035-X
13. Тарасова И.В. Система комплемента. Аллергология и иммунология в педиатрии. 2010;2(21):45-46 [Tarasova I.V. Complement system. Allergology and immunology in pediatrics. 2010;2 (21):45-46 (In Russ.)]. URL: https://cyberleninka.ru/article/n/sistema-komplementa/pdf [дата доступа: 30.06.2025]
14. Калинин Р.Е., Климентова Э.А., Сучков И.А. и др. Влияние системы фибринолиза на исходы применения тромболитической терапии при острой сосудистой патологии. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2024;13(4):631-640 [Kalinin R.E., Klimentova E.A., Suchkov I.A. et al. The influence of the fibrinolysis system on the outcomes of thrombolytic therapy in acute vascular pathology. Sklifosovsky Journal "Emergency Medical Care". 2024;13(4):631-640 (In Russ.)]. https://doi.org/10.23934/2223-9022-2024-13-4-631-640
15. Бокарев И.Н., Мельников А.П., Бурых С.И. Ингибитор фибринолиза, активируемый тромбином, и его клиническое значение. Клиническая медицина. 2023;101(11):521-524 [Bokarev I.N., Melnikov A.P., Burykh S.I. Fibrinolysis inhibitor activated by thrombin and its clinical significance. Clinical Medicine. 2023;101(11):521-524 (In Russ.)]. https://doi.org/10.30629/0023-2149-2023-101-11-521-524
16. Franchini by M., Zaffanello M., Mannucci Р.М. Bleeding Disorders in Primary Fibrinolysis Int. J. Mol. Sci. 2021;22(13): 7027. https://doi.org/10.3390/ijms22137027
17. Saes J.L., Schols S.E.M., van Heerde W.L. et al. Hemorrhagic disorders of fibrinolysis: a clinical review. Journal of Thrombosis and Haemostasis.2018;16(8):1498-1509. https://doi.org/10.1111/jth.14160
18. de Jonge J., Groenland T.H., Metselaar H.J. et al. Fibrinolysis during liver transplantation is enhanced by using solvent/detergent virus-inactivated plasma (ESDEP). Anesth Analg. 2002;94(5):1127-1131. https://doi.org/10.1097/00000539-200205000-00012
19. Franchini M., Zaffanello M., Mannucci P.M. Bleeding Disorders in Primary Fibrinolysis. Int J Mol Sci. 2021;29;22(13):7027. https://doi.org/10.3390/ijms22137027
20. Kolev K., Longstaff C. Bleeding related to disturbed fibrinolysis Br J Haematol. 2016;175(1):12-23. https://doi.org/10.1111/bjh.14255
21. Gao L., Li D., Ding M. Hyperfibrinolysis secondary to acquired factor XIII deficiency A case report. Medicine (Baltimore). 2022;101(29):e29446. https://doi.org/10.1097/MD.0000000000029446
22. Ващенко В.И., Ващенко Т.Н. Биология и физиология протеина С. Современные представления о механизмах лечебного действия активированного пртеина С. Обзоры по клинической фармакологии и лекарственной терапии. 2009;7(3):24-47 [Vaschenko V.I., Vaschenko T.N. Biology and physiology of protein C. Modern concepts of the mechanisms of therapeutic action of activated protein C. Reviews of clinical pharmacology and drug therapy. 2009;7(3): 24-47 (In Russ.)]. URL: https://cyberleninka.ru/article/n/biologiya-i-fiziologiya-proteina-c-sovremennye-predstavleniya-o-mehanizmah-lechebnogo-deystviya-aktivirovannogo-proteina-s [дата доступа: 30.06.2025]
23. Ишемический инсульт и транзиторная ишемическая атака. Клинические рекомендации, 2024. Утверждены Минздравом РФ. [Ischemic stroke and transient ischemic attack. Clinical recommendations, 2024. Approved by the Ministry of Health of the Russian Federation (In Russ.)]. URL: https://cr.minzdrav.gov.ru/preview-cr/814_1_ [дата доступа: 20.06.2025]
24. Altaf F., Wu S., Kasim V. Role of Fibrinolytic Enzymes in Anti-Thrombosis Therapy. Front Mol Biosci. 2021;28(8):680397. https://doi.org/ 10.3389/fmolb.2021.68039
25. Shapiro A.D, Menegatti M., Palla R. et al. An international registry of patients with plasminogen deficiency (HISTORY). Haematologica. 2020;105(3):554-561. https://doi.org/10.3324/haematol.2019.241158
26. Moore H.B. Fibrinolysis Shutdown and Hypofibrinolysis Are Not Synonymous Terms: The Clinical Significance of Differentiating Low Fibrinolytic States. Semin Thromb Hemost. 2023;49(5):433-443. https://doi.org/10.1055/s-0042-1758057
27. Gue, Y.X., Ding, W.Y., Lip, G.Y. et al. Assessment of endogenous fibrinolysis in clinical practice using novel tests: ready for clinical roll-out.2021;3:524 https://doi.org/10.1007/s42452-021-04517-4
28. Longstaff C. Measuring fibrinolysis: from research to routine diagnostic assays. J Thromb Haemost. 2018;16(4):652-662. https://doi.org/: 10.1111/jth.13957
29. Zheng Z, Mukhametova L, Boffa MB, Moore EE, Wolberg AS, Urano T, Kim PY. Assays to quantify fibrinolysis: strengths and limitations. Communication from the International Society on Thrombosis and Haemostasis Scientific and Standardization Committee on fibrinolysis. J Thromb Haemost. 2023;;21(4):1043-1054. https://doi.org/10.1016/j.jtha.2023.01.008
30. Lisman T, de Groot PG, Meijers JC, Rosendaal FR. Reduced plasma fibrinolytic potential is a risk factor for venous thrombosis. Blood. 2005;105(3):1102-5. https://doi.org/10.1182/blood-2004-08-3253
31. Michał Ząbczyk, Robert A S Ariëns, Anetta Undas, Fibrin clot properties in cardiovascular disease: from basic mechanisms to clinical practice, Cardiovascular Research, 2023; 119(1):94–111, https://doi.org/10.1093/cvr/cvad017
32. Stanton K, Philippou H, Ariëns RA. Ischaemic Stroke, Thromboembolism and Clot Structure. Neuroscience. 2024;9:550:3-10. https://doi.org/10.1016/j.neuroscience.2024.02.024
33. Tsantes AG, Parastatidou S, Tsantes EA, Bonova E, Tsante KA, Mantzios PG, Vaiopoulos AG, Tsalas S, Konstantinidi A, Houhoula D, Iacovidou N, Piovani D, Nikolopoulos GK, Sokou R. Sepsis-Induced Coagulopathy: An Update on Pathophysiology, Biomarkers, and Current Guidelines. Life (Basel). 2023;13(2):350. https://doi.org/10.3390/life13020350
34. Kohler HP. Insulin resistance syndrome: interaction with coagulation and fibrinolysis. Swiss Med Wkly. 2002;132(19-20):241-52. https://doi.org/10.4414/smw.2002.09856
35. Flores B, Trivedi HD, Robson SC, Bonder A. Hemostasis, bleeding and thrombosis in liver disease. J Transl Sci. 2017;3(3):10.15761/JTS.1000182. https://doi.org/10.15761/JTS.1000182
36. Saeed Z, Sirolli V, Bonomini M, Gallina S, Renda G. Hallmarks for Thrombotic and Hemorrhagic Risks in Chronic Kidney Disease Patients. Int J Mol Sci. 2024;25(16):8705. https://doi.org/10.3390/ijms25168705
Об авторах
Людмила Олеговна ГуцолРоссия
к.б.н., доцент, доцент кафедры патологической физиологии и клинической лабораторной диагностики
Ирина Эдуардовна Егорова
Россия
к.м.н., доцент, доцент кафедры химии и биохимии
Игорь Жанович Семинский
Россия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики
Евгения Владимировна Гузовская
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Светлана Николаевна Серебренникова
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Людмила Аркадьевна Дмитриева
Россия
к.м.н., зав. лабораторией клинической диагностики
Дополнительные файлы
Рецензия
Для цитирования:
Гуцол Л.О., Егорова И.Э., Семинский И.Ж., Гузовская Е.В., Серебренникова С.Н., Дмитриева Л.А. ФИБРИНОЛИЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА. Байкальский медицинский журнал. 2025;4(3):12-30. https://doi.org/10.57256/2949-0715-2025-4-3-12-30
For citation:
Gutsol L.O., Egorova I.E., Seminsky I.Zh., Guzovskaiia E.V., Serebrennikova S.N., Dmitrieva L.A. FIBRINOLYSIS: MODERN VIEW, PATHOLOGY, DIAGNOSTICS. Baikal Medical Journal. 2025;4(3):12-30. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-3-12-30



















