Перейти к:
МУЛЬТИДИСЦИПЛИНАРНЫЙ ПОДХОД К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
https://doi.org/10.57256/2949-0715-2024-1-11-19
Аннотация
Введение. Синдром диабетической стопы – это одно из тяжёлых осложнений сахарного диабета. Данное сочетание патологических процессов, происходящих в стопе, индуцируется и усугубляется сахарным диабетом.
Наиболее часто синдром диабетической стопы является следствием ангиопатии, невропатии, остеопатии; развиваются инфекционно-язвенные поражения, приводящие к ампутации конечности.
Цель исследования. Оценить результаты диагностики и лечения синдрома диабетической стопы с учётом внедрения мультидисциплинарного подхода.
Материалы и методы. Проведён ретроспективный анализ 151 истории болезней пациентов, у которых диа-гностирован синдром диабетической стопы. Мужчин было 87 (57,6 %), женщин – 64 (42,4 %); средний возраст составил 63,6 ± 1,0 года. У большинства пациентов (139 (92,1 %)) диагностирован сахарный диабет 2-го типа.
Результаты. Мультидисциплинарный подход к диагностике и лечению синдрома диабетической стопы дости-гался усилиями команды специалистов, состоящей из хирурга, терапевта, эндокринолога и ангиохирурга.
Средний уровень гликемии у обследуемых пациентов был выше нормы и составил 10,6 ± 0,4 ммоль/л.
У 111 из них коррекция углеводного обмена осуществлялась инсулинами, в остальных наблюдениях – таблетиро-ванными сахароснижающими препаратами. Всем пациентам проводили лечение, направленное на устранение основных звеньев патогенеза синдрома диабетической стопы. Местное консервативное лечение проведено в 66 наблюдениях, оперативное – в 85. Большинство оперативных вмешательств (40–47 %) составили малые операции (с сохранением опорной функции ноги), у 20 (23,5 %) пациентов выполнены операции на артериях, у 19 (22,4 %) – высокие ампутации (выше голеностопного сустава), у 6 (7,1 %) – вскрытие флегмоны стопы.
Средняя продолжительность лечения больных сахарным диабетом с синдромом диабетической стопы соста-вила 17,1 ± 0,6 дня.
Заключение. У пациентов с синдромом диабетической стопы диагностированы выраженные нарушения углеводного обмена с наличием ангиопатии, невропатии. Мультидисциплинарный подход в диагностике и лече-нии синдрома диабетической стопы позволяет выявить основные звенья патогенеза и на базе имеющихся протоколов индивидуализировать лечение. Это способствует сохранению у большинства пациентов опорной функции конечности, снижению количества высоких ампутаций.
Ключевые слова
Для цитирования:
Белобородов В.А., Фролов А.П. МУЛЬТИДИСЦИПЛИНАРНЫЙ ПОДХОД К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ. Байкальский медицинский журнал. 2024;3(1):11-19. https://doi.org/10.57256/2949-0715-2024-1-11-19
For citation:
Beloborodov V.A., Frolov A.P. MULTIDISCIPLINARY APPROACH TO THE DIAGNOSIS AND TREATMENT OF INFECTIOUS COMPLICATIONS OF DIABETIC FOOT SYNDROME. Baikal Medical Journal. 2024;3(1):11-19. (In Russ.) https://doi.org/10.57256/2949-0715-2024-1-11-19
Введение
Сахарный диабет (СД) — наиболее распространённое эндокринное заболевание человека с постоянной тенденцией увеличения количества больных в мире. В настоящее время СД можно рассматривать как эпидемию XXI века. СД стал развиваться в странах, где он 30 лет назад был редкостью, а сегодня Китай и Индия лидируют по числу людей, страдающих СД. Страны Ближнего Востока и Тихоокеанские острова имеют самую высокую распространённость СД [1]. По суммарной оценке, в 2021 г. во всём мире СД страдали 537 млн человек в возрасте 20—79 лет (10,5 % населения), и ожидается, что число больных к 2030 г. возрастёт до 643 млн, а к 2045 г. — до 783 млн (12,2 %) [2]. Всё это ведёт к перегрузке системы здравоохранения в различных станах мира [3], создаёт огромное экономическое бремя, расходы на одного пациента растут более высокими темпами, чем распространённость СД, и в среднем в 2,3 раза выше, чем у пациентов без СД [2, 4].
С увеличением числа больных СД ожидаемо увеличивается количество его осложнений, одним из которых является синдром диабетической стопы (СДС). СДС — это совокупность патологических процессов в стопе, которые вызываются или усугубляются СД. Диабет поражает множество органов и систем, что приводит к значительной летальности. Пациенты рассматривают СД односторонне, как повышение уровня сахара в крови и ухудшение общего самочувствия, и не рассматривают СД как причину поражения множества систем органом. Это приводит к тому, что население становится исключительно уязвимым к заболеваниям периферических артерий, периферическим невропатиям, остеопатиям, остеопорозам, патологическим переломам, невропатии Шарко, язвам, инфекциям, ампутациям. Так, среди взрослых пациентов с СД продолжительностью 9—11 лет отмечается сенсорная невропатия у 29— 56 %, а заболевания периферических артерий — у 13,5—36 % [5]. В 2005 г. примерно 592 000 пациентов с СД перенесли ампутацию нижних конечностей, из них 60 % были выполнены высокие ампутации, к 2050 г. их количество удвоится [6].
Одним из самых тяжёлых вариантов течения СДС является образование язв. Язвы являются одним из ключевых факторов, способствующих инфицированию и потере конечностей [7]. Чтобы обеспечить эффективную оценку, лечение осложнений и проведение профилактических мероприятий, чрезвычайно важно определить причину язвообразования. Причины диабетической язвы стопы многофакторные: периферическая сенсорная невропатия, биомеханические аномалии стопы и голеностопного сустава, внешние травмы, микро- и макроангиопатия. Язвы на стопе обычно возникают в местах умеренного или высокого давления на стопу и сдвигающих усилий, возникающих в результате повторяющихся травм. Из-за сенсорной невропатии пациенты часто не распознают наличие язвы на стопе. Участки аномального давления и сдвига часто связаны с деформациями стопы, такими как молоткообразные пальцы, вальгусная деформация стопы, ригидный изгиб стопы, стопа Шарко [7—9].
За последние десятилетия были разработаны и внедрены международные рекомендации, а также программы по лечению СДС. Разработаны инновационные технологии для лечения и профилактики СДС, такие как: мониторинг температуры в домашних условиях; лечение ран отрицательным давлением; гиперспектральная визуализация; местный кислород; специальные повязки (атравматические, гелевые, коллоидные, альгинатные), препараты на основе стволовых клеток. Следует отметить достижения в области сосудистой хирургии, особенно эндоваскулярных вмешательств, которые также внесли огромный вклад в улучшение результатов и снижение хирургических рисков. Появились новые подходы к лечению невроартропатии Шарко. Улучшились результаты лечения сенсорной невропатии [10, 11].
Несмотря на появление новых технологий и протоколов лечения СДС, проблемы лечения инфекционных осложнений остаются крайне актуальными, что подтверждает большое количество ежегодно выполняемых ампутаций.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Провести анализ диагностики и лечения инфекционных осложнений синдрома диабетической стопы с учётом мультидисциплинарного подхода и использования современных технологий у пациентов, находящихся на лечении в хирургическом стационаре.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн и участники исследования
На базе отделения гнойной хирургии проведено ретроспективное исследование с участием 151 пациента с СДС. В исследуемую группу были включены пациенты различного пола и возраста. Средний возраст составил 63,6 ± 1,3 года. В исследуемой группе преобладали мужчины — 87 (57,6 %), женщин, соответственно, было 64 (42,4 %). Большинство пациентов с СДС имели СД 2-го типа — 139 (92,1 %), СД 1-го типа отмечался редко — в 12 (7,9 %) случаях.
Описание медицинского вмешательства
Диагностика клинических форм СДС осуществлялась на основе клинико-инструментального обследования. Диагностика диабетической невропатии проводилась путём определения тактильной (тест Semmes — Weinstein), температурной и вибрационной (с использованием камертона) чувствительности, определялся сухожильный рефлекс с ахиллова сухожилия. Диабетическая ангиопатия диагностировалась на основании клинических проявлений ишемии (перемежающейся хромоты), допплерографии с определением лодыжечно-плечевого индекса, мультиспиральной компьютернотомографической агиографии, цветного дуплексного ультразвукового сканирования. Выявление диабетической остеоартропатии (стопы Шарко) основывалось на оценке клинической симптоматики и рентгенографии стопы, на которой нередко выявлялся кальциноз артерий — диагностический признак ангиопатии. Диагностика инфекционных осложнений базировалась прежде всего на основе анамнеза и клинической симптоматики. Лабораторные и инструментальные методы исследования носили вспомогательное значение.
Исходы исследования
В ходе исследования изучение следующие данные: 1) пол; 2) возраст пациентов; 3) лабораторные показатели периферической крови; 4) локализация поражения артерий нижних конечностей; 5) стадия СДС по классификации F. Wagner (1981); 6) продолжительность формирования признаков инфекционного процесса; 7) виды хирургических пособий при СДС; 8) продолжительность пребывания пациентов в стационаре.
Статистический анализ данных
Непрерывные переменные представлены в виде средних значений (M) и их стандартных отклонений (SD), категориальные переменные — в виде их количества (n) и частоты встречаемости (%). Статистическую обработку данных проводили c помощью программных обеспечений Microsoft Excel 2016 (Microsoft Corp., США) и SPSS 22.0 (IBM Corp., США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Всем пациентам с СДС, поступившим в хирургическое отделение стационара, проводилось комплексное обследование и лечение. С этой целью создавалась мультидисциплинарная команда в составе лечащего врача — хирурга, ангиохирурга, терапевта и эндокринолога, которые совместно определяли индивидуальную концепцию лечения. Также по показаниям в команду мог включаться невролог. Задачами хирурга были диагностика характера инфекционных осложнений, предварительная оценка состояния периферического кровообращения, выявление наличия артропатии, оценка сенсорной невропатии и непосредственное лечение гнойных осложнений. Ангиохирург оценивал характер нарушения периферического кровообращения, определял возможность выполнения реконструктивно-восстановительных операций на артериях и осуществлял их, включая эндоваскулярные вмешательства с привлечением ангиорентгенологов. Задачами терапевта были диагностика и лечение сопутствующей патологии. Основной задачей эндокринолога являлась коррекция углеводного обмена. В случае, если поставленная задача специалистом была решена на догоспитальном этапе, то в мультидисциплинарную команду он не включался. 131 (86,8 %) пациент с СДС за период госпитализации был проконсультирован врачом-терапевтом, 129 (85,4 %) — эндокринологом, 122 (80,8 %) — ангиохирургом, 5 (3,3 %) — неврологом. У большинства пациентов (140 (92,7 %)) диагностированы различные проявления метаболического синдрома: артериальная гипертензия — у 129 (85,4 %), ожирение — у 28 (18,5 %), ишемическая болезнь сердца — у 106 (70,2 %).
На основании проведённых исследований определялись характер оперативного лечения, сроки его проведения, методы коррекции углеводного обмена и устранения дисфункций органов.
В ходе первичного обследования было установлено, что средний уровень глюкозы крови у 151 пациента составил 10,6 ± 0,4 ммоль/л, гликированный гемоглобин — 8,9 ± 0,2 % при должном 7,6 ± 0,2 %. До поступления в стационар коррекция углеводного обмена у 111 (73,5 %) пациентов проводилась с помощью базально-болюсной схемы инсулинотерапии. Доза инсулина короткого действия составляла 24,11 ± 0,50 Ед, продлённого — 27,16 ± 1,26 Ед. 10 (6,6 %) пациентов получали только инсулин короткого действия в средней дозе 20,82 ± 3,43 Ед. Таблетированные сахароснижающие препараты получали 23 (15,2 %) пациентов с СД 2-го типа, 10 из них — в сочетании с продлённым инсулином. 7 пациентов с СДС до поступления в стационар не получали сахароснижающую терапию.
Выявление дисфункций органов и систем базировалось на лабораторных исследованиях крови и мочи инструментальными методами. Оценка функции желудочно-кишечного тракта выполнялась на ультразвуковом исследовании брюшной полости, дыхательной системы — на рентгенографии лёгких, сердечно-сосудистой системы — на измерении артериального давления и электрокардиографии. Проведённые лабораторные исследования показателей крови выявили умеренный лейкоцитоз; других существенных их изменений в крови не выявлено (табл. 1). Инструментальные исследования не выявили критичных дисфункций органов и систем, что не потребовало их специального лечения.
Для уточнения характера инфекционного поражения стопы, выявления остеоартропатии и кальциноза артерий (синдром Менкеберга) 89 пациентам была выполнена рентгенография стопы. Из них у 64 пациентов был выявлен кальциноз артерий, у 34 — признаки остеомиелита, у 3 — периостит. Ультразвуковая допплерография выполнена 32 пациентам, у 13 из них выявлены признаки кальциноза артерий.
В последующем, после первичного осмотра и начатого консервативного лечения, при наличии показаний в течение 3 дней выполняли артериографию для выявления возможности проведения реконструктивной операции на артериях нижних конечностей с целью сохранения их опорной функции. Артериография была выполнена у 54 пациентов. Из них в 44 наблюдениях выявлено окклюзионное поражение большеберцовой артерии, которое чаще всего сочеталось со стенозом и окклюзией артерий на стопе и со стенозом и окклюзией поверхностной бедренной артерии. Стеноз большеберцовой артерии встречался редко (5 случаев), как и поражение магистральных артерий (4 случая).
При комплексном обследовании у 151 пациента с СДС на основании ультразвукового исследования и допплерометрии артерий, ангиографии во всех наблюдениях была выявлена диабетическая ангиопатия. В подавляющем числе наблюдений (133) она носила сочетанный характер (сочетание микроангиопатии с макроангиопатией). Микроангиопатия была отмечена у 13 пациентов, макроангиопатия — у 5. Диагностика диабетической невропатии основывалась на выявлении снижения болевой и тактильной чувствительности в стопах. Невропатия выявлена в 140 наблюдениях у пациентов, имеющих ангиопатию. У 11 пациентов с ангиопатией признаков невропатии не выявлено. Кроме того, на основании рентгенографии стоп у 30 пациентов выявлена остеоартропатия. При дополнительном обследовании у 27 пациентов обнаружена нефропатия, у 6 — ретинопатия.
На основании клинического осмотра всем пациентам была определена стадия поражения стоп инфекционным процессом по F. Wagner (1981). Реже всего больные обращались в хирургическое отделение с 0-й степенью заболевания (8 случаев), основными проявлениями которой были рожа и целлюлит. Пациенты с 1-й стадией (поверхностные язвенные дефекты) и 2-й стадией (глубокие язвенные дефекты мягких тканей) госпитализировались в 1,5—2 раза чаще (19 и 11 случаев соответственно). Пациентов с 3-й стадией заболевания (глубокая язва, проникающая до костных структур) было больше, чем с 0—2-й стадиями (38 случаев). Самой частой причиной госпитализации пациентов с СДС была 4-я стадия заболевания — развитие ограниченной гангрены стопы (62 случая), 5-я стадия (распространённая гангрена стопы) была у 17 пациентов.
Таблица 1. Лабораторные показатели крови у пациентов с инфекционными осложнениями синдрома диабетической стопы
Показатели крови | Среднее, М | Стандартное отклонение (SD) |
Эритроциты, ×1012/л | 4,30 | 0,07 |
Гемоглобин, г/л | 121,08 | 1,95 |
Гематокрит | 36,34 | 0,47 |
Лейкоциты, ×109/л | 10,52 | 0,37 |
Билирубин, мкмоль/л | 13,26 | 0,94 |
Амилаза, ммоль/л | 43,03 | 5,76 |
Мочевины, ммоль/л, | 7,75 | 1,28 |
Креатинин, ммоль/л | 108,32 | 13,13 |
Холестерин, ммоль/л | 5,57 | 1,35 |
Липопротеины низкой плотности, ммоль/л | 6,28 | 3,03 |
Липопротеины высокой плотности, ммоль/л | 4,18 | 3,12 |
Триглицериды, ммоль/л. | 5,16 | 3,31 |
K+, ммоль/л | 4,15 | 0,16 |
Na+, ммоль/л | 135,96 | 1,70 |
Cl–, ммоль/л | 96,0 | 5,10 |
Глюкоза, ммоль/л, | 10,6 | 0,4 |
Средняя продолжительность развития инфекционного процесса составила 31,4 ± 3,3 дня. В течение 1-х суток пребывания в хирургическом отделении 94 пациентам проведён забор экссудата из очага поражения стопы для бактериологического исследования. По результатам посева основным патогеном являлся золотистый стафилококк (59 (62,8 %) пациентов), реже — стрептококк (6 (6,4 %) пациентов), протей (6 (6,4 %) пациентов), синегнойная (6 (6,4 %) пациентов) и кишечная (3 (3,2 %) пациента) палочка. Грамотрицатель- ная микрофлора выделена у 14 (14,8 %) пациентов.
На основании выявленных основных звеньев патогенеза формировался соответствующий лечебный комплекс, в который включали коррекцию углеводного обмена, лечение ангиопатии, невропатии, антибактериальную терапию с учётом характера микрофлоры.
Во время стационарного лечения все пациенты с СДС получали инсулин короткого действия с целью поддержания уровня гликемии в пределах 5,5—10,0 ммоль/л. В составе комплексной терапии невропатии при СДС использовались метаболические и антиоксидантные препараты (ти- октацид — 600 мг/сут., актовегин — 1 г/сут., витамины В, С, Е или мильгамма). Медикаментозная коррекция ангиопатии проводилась с помощью де- загрегантов и антикоагулянтов, таких как гепарин до 20 тыс. Ед/сут., реополиглюкин — 400 мл/сут., никотиновая кислота — 0,04 г/сут., так и низкомолекулярные гепарины — фраксипарин в дозе 0,3— 0,6 мл/сут., сулодексид в дозе 600 ЛЕ/сут.; последние имели ряд преимуществ. При развитии критической ишемии конечности в лечении применяли препараты простагландина Е1 (вазопростан).
В случае выраженного отёка стопы к лечению дополняли препаратами диосмина (детралекс, вазо- кет). После купирования явлений острого инфекционного процесса в стопе применялись таблетированные формы дезагрегантов и антикоагулянтов: аспирин (0,25 мг/сут.) или плавикс (75 мг/сут.).
Наличие СДС являлось показанием к проведению антибактериальной терапии. При стартовой терапии назначались антибиотики (цефалоспорины III поколения или фторхинолоны), которые применялись в сочетании c метронидазолом, или назначался амоксициллин/клавуланат. После верификации микрофлоры из язв при бактериологическом исследовании их и чувствительности к антибиотикам проводилась коррекция антибактериальной терапии.
У 66 (43,7 %) пациентов, имеющих 0—3-ю стадии СДС по классификации F. Wagner (1981), проводилось только местное консервативное лечение (рис. 1). Оно включало обязательную разгрузку конечности, которая достигалась наложением на стопу и голень лонгеты из синтетического материала для иммобилизации стопы с последующим хождением на костылях или ношением специальной ортопедической обуви. Пациентам с СДС с язвами или ранами выполнялись механический дебрид- мент или ультразвуковая кавитация, ежедневно проводились перевязки с антисептическими растворами, протеолитическими ферментами, различными атравматическими и адсорбирующими повязками. Гидрогелевые или гидроколлоидные повязки выполнялись после очищения язв от инфекции и детрита. Широко использовались возможности физиотерапии как на I, так и на II стадии раневого процесса (ультрафиолетовое облучение, магнитотерапия, лазеротерапия). Для ускорения очищения и заживления диабетичесих язв в ряде случаев применялась гипербарическая оксигенация и озонотерапия.
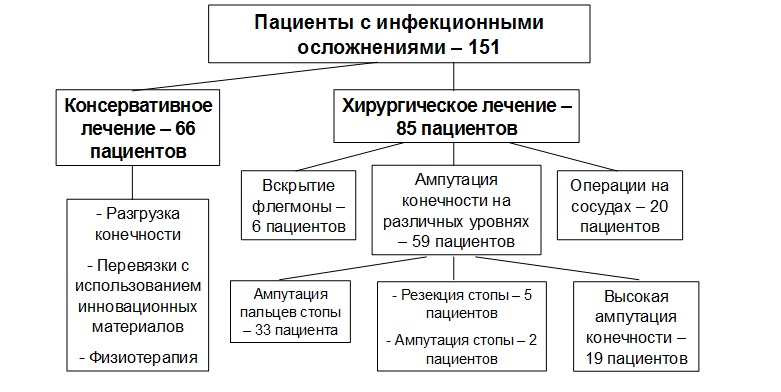 |
Рис. 1. Структура местного лечения инфекционных осложнений синдрома диабетической стопы. |
Хирургическое лечение в сочетании с консервативной терапией выполнено 85 (56,3 %) пациентам. Характер оперативного лечения представлен на рисунке 1.
Основным видом хирургического лечения явились ампутации нижней конечности на различных уровнях (59 (69,4 %) пациентов). Чаще всего выполнялись малые ампутации в пределах стопы с сохранением опорной функции конечности (40 (67,8 %) пациентов). Показанием к операции служила 4-я стадия заболевания с сохранённым кровотоком на стопе. Высокие ампутации (на уровне голени и бедра) были выполнены 19 (32,2 %) пациентам, из них 17 имели 5-ю стадию СДС, 2 — 4-ю стадию, с существенным нарушением кровотока на стопе, который не удалось восстановить консервативными и хирургическими методами.
Значительной части пациентов с 4-й стадией СДС (20 (23,5 %) пациентов) выполнены операции на артериях с целью нормализации кровотока и с последующим выполнением малой ампутации. Из них у 10 (50%) пациентов выполнена баллонная дилатация со стентированием берцовых артерий, у 7 (35 %) — пластика бедренной артерии в сочетании с баллонной дилатацией берцовых артерий, 3 (15 %) — шунтирование и протезирование с пластикой бедренной артерии.
Вскрытие флегмоны с хирургической обработкой раны выполнено в 6 (7,1 %) наблюдениях. Средняя продолжительность лечения пациентов с инфекционными осложнениями СДС составила 17,1 ± 0,6 дня.
ОБСУЖДЕНИЕ
Как правило, гнойные проявления СДС наблюдались у больных старше 60 лет со вторым типом СД; мужчины болели несколько чаще, чем женщины, что согласуется с литературными данными — увеличением частоты осложнений СД с возрастом и заболеванием мужчин в 1,5 раза чаще [11].
Ввиду поражения множества органов и систем при СД, приводящих к различным патологическим состояниям, в том числе к инфекционным осложнениям на стопе, возникает необходимость использования мультидисциплинарного подхода к диагностике и лечению, который сформировался за последние 5—10 лет. С этой целью формировалась команда врачей-специалистов по диагностике и лечению заболеваний различных органов и систем.
Для инфекционных проявлений СДС было характерно выраженное нарушение углеводного обмена, наличие ангиопатии во всех наблюдениях и, как правило, невропатии; существенно реже наблюдались поражения суставов, почек, сетчатки глаза. С учётом выявленных патологических процессов всем пациентам требовалось проведение комплексного лечения. Выполнялась коррекция углеводного обмена, консервативное лечение ангиопатии и полиневропатии, по показаниям — лечение артропатии, нефропатии, ретинопатии. При наличии или угрозе распространения местного инфекционного процесса осуществлялась антибактериальная терапия [10].
Местная консервативная терапия без хирургического лечения проведена 43,7 % пациентам с СДС. Комплекс лечебных мероприятий определился стадией раневого процесса и соответствовал общим рекомендациям лечения диабетических язв [12], однако в деталях были отличия.
В первую стадию наиболее оптимальным лечением явилось: 1) при преобладании некротических тканей — ультразвуковая кавитация и/или повязки с ферментными препаратами; 2) при преобладании гнойного процесса — повязки с раствором повидон-йода или инновационные адсорбирующие повязки.
Во вторую стадию раневого процесса наиболее оптимально подходили атравматические сетчатые повязки или повязки на основе геля или коллоида. Физиотерапия носила вспомогательный характер. Гипербарическая оксигенация и озонотерапия были достаточно эффективны, но из-за организационных сложностей использовались редко.
Вследствие инфекционных проявлений СДС 56,3 % пациентов потребовалось выполнение хирургического лечения. Самым распространённым хирургическим методом лечения явилась ампутация нижней конечности на уровне нормального кровоснабжения в 39,1 % наблюдений, в отличие от 68,6 % в польском сообщении [8]. Высокие ампутации были выполнены у 12,6 % пациентов, что ниже 20 %, представленных в обзорном сообщении из США, Англии и Нидерландов [10].
Малые ампутации выполнены у 26,5 % пациентов. Важнейшей задачей при выборе данного уровня ампутации явилась нормализация кровообращения. Это достигалось дополнительной консервативной терапией, открытыми реконструктивно-восстановительными операциями на подвздошных и бедренных артериях, малоинвазивными эндоваскулярными технологиями, что позволяло выполнять малые ампутации с сохранением опорной функции конечности. В конечном итоге при данной тактике 77,6 % оперированных пациентов сохранили опорную функцию конечности, 22,4 % — выполнена высокая ампутация. Летальных исходов в течение 30-суточного послеоперационного периода в этой группе больных СДС не было, что положительно отличается от таковых результатов в опубликованных источниках, где летальность составила 3,5—34 % [8].
ЗАКЛЮЧЕНИЕ
Пациенты с СДС имеют существенные нарушения углеводного обмена, наличие ангиопатии и невропатии. Мультидисциплинарный подход в диагностике и лечении СДС позволяет выявить основные звенья патогенеза и на базе имеющихся протоколов индивидуализировать лечение. Это позволяет у большинства пациентов сохранить опорную функцию конечности, снизить количество высоких ампутаций и тем самым частично сохранить качество жизни.
Список литературы
1. Naeem Z. Burden of diabetes mellitus in Saudi Arabia. Int J Health Sci (Qassim). 2015;9(3):V-VI. DOI:10.12816/0024690
2. IDF Diabetes Atlas 2021-10th ed. Available online: https://diabetesatlas.org [accessed: 26.09.2023].
3. Ogurtsova K., da Rocha Fernandes J.D., Huang Y. et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 2017;128:40-50. DOI:10.1016/j.diabres.2017.03.024
4. American Diabetes Association. Economic Costs of Diabetes in the U.S. in 2017. Diabetes Care. 2018;41(5):917-928. DOI:10.2337/dci18-0007
5. Shukla V., Fatima J., Ali M., Garg A. A Study of Prevalence of Peripheral Arterial Disease in Type 2 Diabetes Mellitus Patients in a Teaching Hospital. J Assoc Physicians India. 2018;66(5):57-60.
6. Ziegler-Graham K., MacKenzie E.J., Ephraim P.L. et al. Estimating the prevalence of limb loss in the United States: 2005 to 2050. Arch Phys Med Rehabil. 2008;89(3):422-429. DOI:10.1016/j.apmr.2007.11.005
7. Humphries M.D., Brunson A., Li C.-S., Melnikow J., Romano P.S. Amputation trends for patients with lower extremity ulcers due to diabetes and peripheral artery disease using statewide data. J Vasc Surg. 2016;64(6):1747-1755.e3. DOI:10.1016/j.jvs.2016.06.096
8. Walicka M., Raczyńska M., Marcinkowska K. et al. Amputations of Lower Limb in Subjects with Diabetes Mellitus: Reasons and 30-Day Mortality. J Diabetes Res. 2021;2021:8866126. DOI:10.1155/2021/8866126.
9. Matijević T., Talapko J., Meštrović T. et al. Understanding the multifaceted etiopathogenesis of foot complications in individuals with diabetes. World J Clin Cases. 2023;11(8):1669-1683. DOI:10.12998/wjcc.v11.i8.1669
10. Armstrong D.G., Tan T.-W., Boulton A.J.M., Bus S.A. Diabetic foot ulcers: a review. JAMA. 2023 Jul 3;330(1):62-75. DOI: 10.1001/jama.2023.10578
11. McDermott K., Fang M., Boulton A.J.M., Selvin E., Hick C.W. Etiology, epidemiology, and disparities in the burden of diabetic foot ulcers. Diabetes Care. 2023;46(1):209-221. DOI:10.2337/dci22-0043
12. Lipsky B.A., Senneville É., Abbas Z.G. et al. Guidelines on the diagnosis and treatment of foot infection in persons with diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020;36Suppl 1:e3280. DOI: 10.1002/dmrr.3280
Об авторах
Владимир Анатольевич БелобородовРоссия
д.м.н., профессор, зав. кафедрой общей хирургии ФГБОУ ВО ИГМУ Минздрава России
Александр Петрович Фролов
Россия
к.м.н., доцент кафедры общей хирургии ФГБОУ ВО ИГМУ Минздрава России
Рецензия
Для цитирования:
Белобородов В.А., Фролов А.П. МУЛЬТИДИСЦИПЛИНАРНЫЙ ПОДХОД К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ. Байкальский медицинский журнал. 2024;3(1):11-19. https://doi.org/10.57256/2949-0715-2024-1-11-19
For citation:
Beloborodov V.A., Frolov A.P. MULTIDISCIPLINARY APPROACH TO THE DIAGNOSIS AND TREATMENT OF INFECTIOUS COMPLICATIONS OF DIABETIC FOOT SYNDROME. Baikal Medical Journal. 2024;3(1):11-19. (In Russ.) https://doi.org/10.57256/2949-0715-2024-1-11-19
















