Перейти к:
АНАЛИЗ ДИНАМИКИ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ УРОПАТОГЕНОВ У ПАЦИЕНТОВ В МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ
https://doi.org/10.57256/2949-0715-2023-4-45-52
Аннотация
Инфекции мочевых путей относятся к числу самых распространенных бактериальных инфекций. В настоящее время одной из основных проблем терапии, как и в случае инфекций других локализаций, является высокий уровень антибиотикорезистентности. В свою очередь, своевременно назначенная и адекватно выбранная антимикробная терапия является главным фактором, определяющим результат лечения пациентов.
Цель. Динамический анализ этиологической структуры микрофлоры мочевыводящих путей, оценка антибиотикорезистентности наиболее значимых уропатогенов у пациентов отделений Клиник ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России (Клиники ИГМУ) с целью оптимизации применения антимикробных лекарственных средств в многопрофильном стационаре.
Материалы и методы. Проведен анализ штаммов бактерий (n=2414), полученных из мочи пациентов, находившихся на лечении в Клиниках ИГМУ в период 2018-2022 гг. Микробиологическое исследование мочи выполнялось в бактериологической лаборатории Клиник ИГМУ.
Результаты. На протяжении исследуемого периода основным уропатогеном остается E. coli. Отмечается рост антибиотикорезистентности E. coli к основным антимикробным препаратам (АМП), традиционно применяемым для лечения инфекций мочевыводящих путей, в том числе препаратам группы фторхинолонов и цефалоспоринов III поколения. Отмечается увеличение частоты выявления штаммов E. coli, продуцирующих бета-лактамазы расширенного спектра (БЛРС) с 5,4 % до 12,4 %. Наибольшая активность в отношении E. coli сохраняется у меропенема и нитрофурантоина.
Заключение. Результаты данного исследования свидетельствуют о необходимости усиления контроля за применением АМП в медицинских организациях, важности проведения постоянного микробиологического мониторинга с целью выявления особенностей локальной антибиотикорезистентности и актуализации протоколов эмпирической терапии инфекций мочевыводящих путей.
Ключевые слова
Для цитирования:
Двойникова Н.А., Алексеева Н.Ю., Зарва И.Д. АНАЛИЗ ДИНАМИКИ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ УРОПАТОГЕНОВ У ПАЦИЕНТОВ В МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ. Байкальский медицинский журнал. 2023;2(4):45-52. https://doi.org/10.57256/2949-0715-2023-4-45-52
For citation:
Dvoynikova N., Alekseeva N., Zarva I. ANALYSIS OF THE DYNAMICS OF UROPATHOGENS ANTIMICROBIAL RESISTANCE IN PATIENTS OF MULTI-SPECIALTY HOSPITAL. Baikal Medical Journal. 2023;2(4):45-52. (In Russ.) https://doi.org/10.57256/2949-0715-2023-4-45-52
Введение
Инфекции мочевых путей (ИМП) относятся к числу самых распространенных бактериальных инфекций, которые широко встречаются как в амбулаторной практике, так и в условиях стационара [1]. В настоящее время одной из основных проблем терапии ИМП, как и в случае инфекций других локализаций, является высокий уровень антибиотикорезистентности. На протяжении последних лет в России отмечается неуклонный рост устойчивости уропатогенов к основным АМП, традиционно используемым для лечения ИМП [2,3]. В первую очередь это касается E. coli, являющейся основным возбудителем внебольничных ИМП. В клинической практике при урологических инфекциях антибактериальная терапия, как правило, назначается эмпирически. При этом, считается, что если уровень резистентности возбудителя к какому-либо АМП составляет более 10-20 %, то данный препарат не может быть рекомендован для схем эмпирической терапии. Поэтому при назначении стартовой терапии ИМП знание локальной антибиотикорезистентности ведущих уропатогенов играет решающую роль, что позволяет сделать выбор в пользу препаратов, к которым отмечается наименьший уровень устойчивости. В свою очередь, правильно выбранная и своевременно назначенная антимикробная терапия является главным фактором, определяющим результат лечения пациентов с ИМП.
Цель работы: динамический анализ этиологической структуры микрофлоры мочевыводящих путей, оценка антибиотикорезистентности наиболее значимых уропатогенов у пациентов отделений Клиники ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России (Клиники ИГМУ) с целью оптимизации применения антимикробных лекарственных средств в многопрофильном стационаре.
Материалы и методы
Проведен анализ 2414 штаммов бактерий, полученных из мочи пациентов, находившихся на лечении в Клиниках ФГБОУ ВО ИГМУ Минздрава России в 2018-2022 г.г. Микробиологическое исследование мочи выполнялось в бактериологической лаборатории Клиник ФГБОУ ВО ИГМУ Минздрава России.
Результаты исследования
Согласно полученным результатам, на протяжении всего исследуемого периода в структуре урокультуры лидирующее место занимает E. coli. (Таблица 1). Частота выявления данного возбудителя составляет более 60% с незначительными колебаниями (от 62,6 % до 66,4 %). На втором месте находится E. faecalis. Выявляемость данного патогена в течение исследуемого периода составила от 11,4 % до 14 %. Как правило, грамположительные бактерии, в том числе энтерококки, являются возбудителями нозокомиальных инфекций. Третью позицию занимает K.pneumoniae с частотой выявления от 7,1% в 2018 г. до 9,3 % в 2022 г. На долю других представителей Enterobacteriaceae (Enterobacter spp., Proteus spp. и др.) приходится от 1 % до 2 %. Выявляемость S. epidermidis составила от 3,5 % до 5,1 %. В настоящее время эпидермальный стафилококк не рассматривается в качестве значимого уропатогена. Как правило, выделение данного микроорганизма из мочи расценивается как контаминация [4].
Таблица 1. Видовая структура штаммов, исследованных в микробиологической лаборатории Клиник ИГМУ в 2018-2022 гг.
| Число иссл. (абс.) | Доля от общего числа выделенных изолятов в % (95% ДИ) |
E.сoli | 1558 | 64,5 (62,6 - 66,4) |
E. faecalis | 306 | 12,7 (11,4 - 14) |
K. pneumoniae | 198 | 8,2 (7,1 - 9,3) |
Прочие | 117 | 4,8 (3,9 - 5,7) |
S. epidermidis | 103 | 4,3 (3,5 - 5,1) |
Streptococcus spp. | 66 | 2,7 (2,1 - 3,3) |
Другие энтеробактерии | 35 | 1,5 (1 - 2) |
S. aureus | 31 | 1,3 (0,9 - 1,7) |
Проведен анализ антибиотикорезистентности полученных штаммов микроорганизмов. Интерес, прежде всего, представляла динамика устойчивости к АМП изолятов E.coli, поскольку в структуре выделенных микроорганизмов этот уропатоген занимает лидирующую позицию (рис. 1).
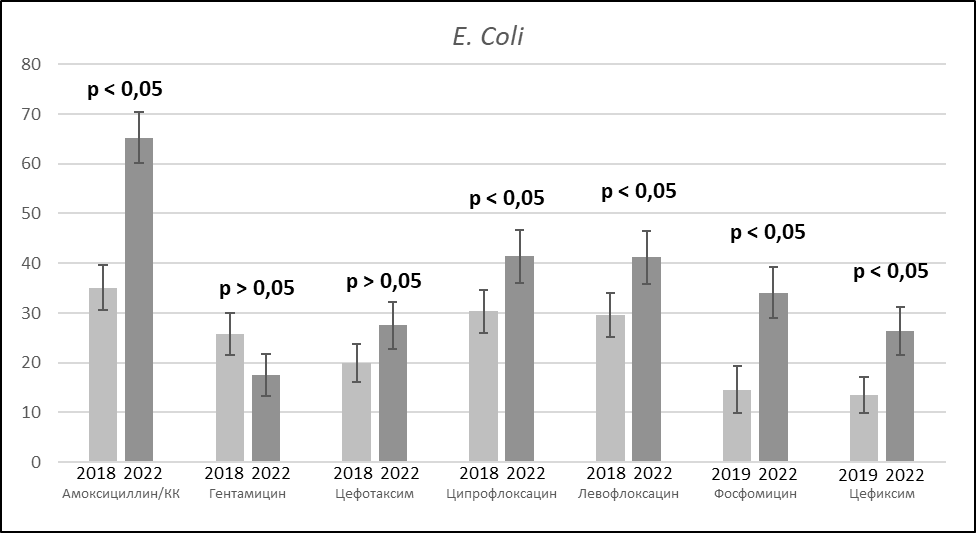
Рисунок 1. Изменение антибиотикорезистентности штаммов E. сoli.
Результаты анализа показали, что наименьшую активность в группе АМП, применяемых для лечения ИМП, проявляет амоксициллин/клавуланат. В 2022 г. доля штаммов, устойчивых к данному АМП, составила 65,2 % по сравнению с 35,1 % в 2018 г. В динамике отмечается статистически значимое снижение чувствительности возбудителя к фторхинолонам – в 2022 г. доля резистентных штаммов E. сoli составила 41,2 % для левофлоксацина и 41,4 % для ципрофлоксацина, что сопоставимо с данными, полученными в российском эпидемиологическом исследовании «ДАРМИС-2018» [3]. Кроме того, необходимо отметить рост резистентности изолятов E. coli к цефалоспоринам III. Устойчивость возбудителя к цефотаксиму в 2022 г. составила 27,5 %, к цефиксиму – 26,4 %. Наибольшая активность в отношении E. coli сохраняется у меропенема. В 2018 г. и 2020 г. было выявлено по 1 штамму, резистентному к данному АМП, в остальных случаях чувствительность изолятов к меропенему была сохранена.
В группе препаратов, используемых при лечении инфекций нижних мочевых путей, высокая активность отмечается у нитрофурантоина. Число штаммов, чувствительных к данному препарату в 2022 г. составила 98,6 % (ранее чувствительность к нитрофуранам не определялась). При этом в динамике отмечается статистически значимое снижение чувствительности E. coli к другому пероральному АМП – фосфомицину. В 2022 г. доля штаммов, резистентных к данному препарату, составила 34,1 % по сравнению с 14,6 % в 2019 г.
Отдельно следует обратить внимание на рост среди выделенных изолятов E. coli количества штаммов, продуцирующих БЛРС – с 5,4 % до 12,4 %, что является статистически значимым (рис.2).
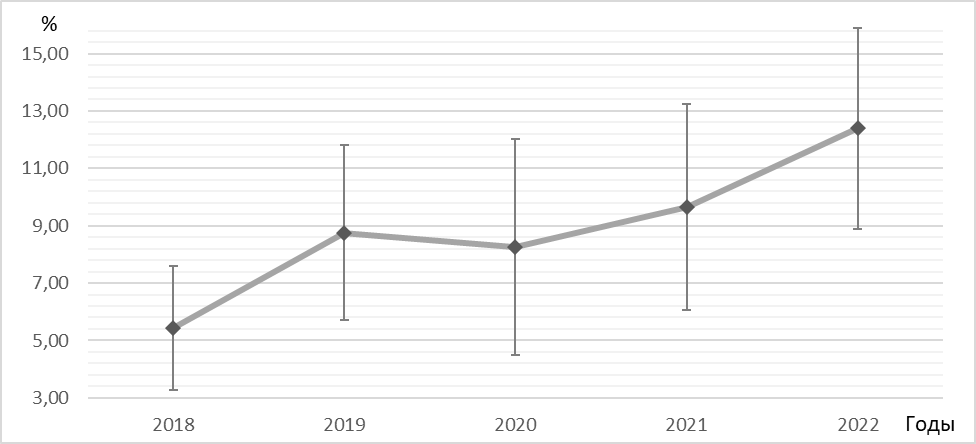
Рисунок 2. Динамика доли штаммов, продуцирующих БЛРС от общего числа исследованных изолятов E. Сoli, с 2018 по 2022 гг.
При анализе резистентности E. faecalis к антибактериальным препаратам обращает на себя внимание снижение чувствительности возбудителя к аминопенициллинам. В 2022 г. доля штаммов, резистентных к ампициллину, составила 17,5 % по сравнению с 12,6 % в 2018 г.
В динамике также отмечается снижение чувствительности патогена к фторхинолонам. Только ванкомицин сохраняет высокую активность в отношении данного возбудителя. В 2018 г. и 2022 г. были выявлены единичные штаммы, резистентные к данному АМП, в остальных случаях чувствительность изолятов к ванкомицину была сохранена (рис. 3).
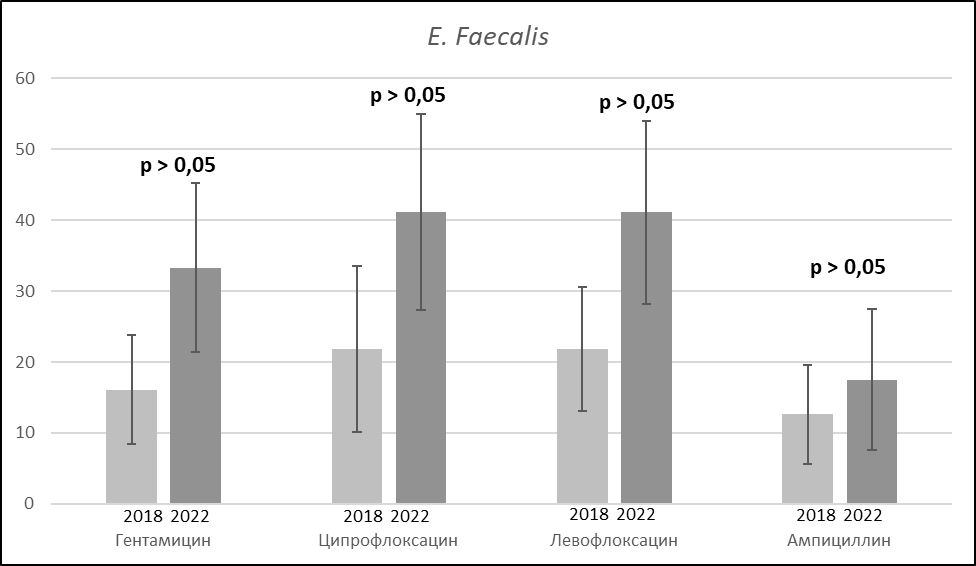
Рисунок 3. Изменение антибиотикорезистентности штаммов E. faecalis.
Также проведен анализ чувствительности к антимикробным препаратам (АМП) выделенных штаммов K. pneumoniae. Динамика антибиотикорезистентности возбудителя представлена на рисунке 4.
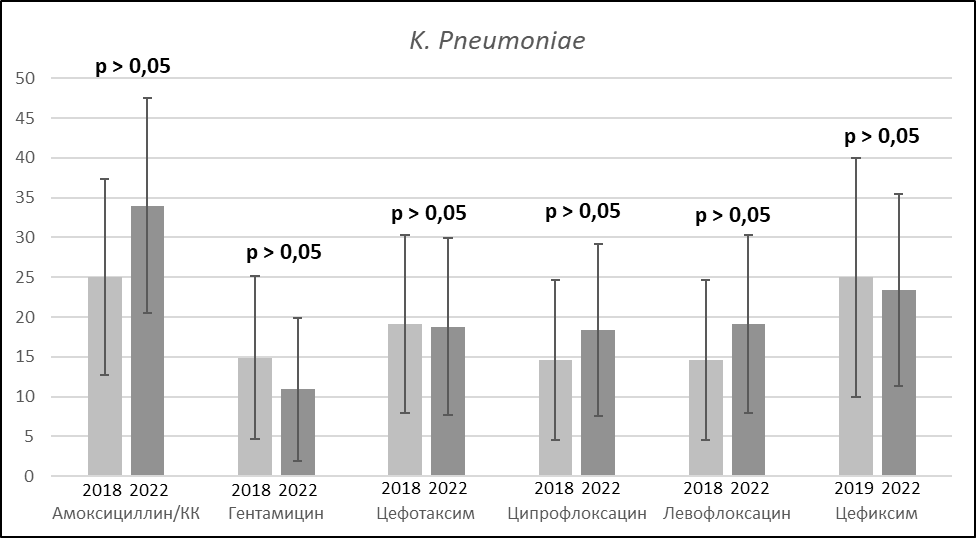
Рисунок 4. Изменение антибиотикорезистентности штаммов K. Pneumoniae.
Обсуждение
Результаты анализа антибиотикорезистентности микрофлоры мочевыводящих путей у пациентов отделений Клиник ФГБОУ ВО ИГМУ Минздрава России в основном соответствуют данным, полученным в российском эпидемиологическом исследовании «ДАРМИС-2018». Выявлен высокий уровень устойчивости основного возбудителя ИМП E. coli как к фторхинолонам, так и к цефалоспоринам III. Увеличение частоты резистентности к фторхинолонам в динамике является крайне негативной тенденцией, так как АМП данной группы являются препаратами выбора при лечении острого пиелонефрита. Вероятно, такой рост устойчивости связан в том числе и с тем, что до недавнего времени фторхинолоны широко применялись для лечения неосложненных инфекций нижних мочевых путей, прежде всего, острого цистита у женщин [5,6]. В настоящее время препараты данной группы исключены из рекомендаций по лечению цистита [7,8]. Росту резистентности к фторхинолонам способствует также необоснованное назначение этих препаратов при бессимптомной бактериурии или лейкоцитурии неуточненного генеза [9, 10]. Хотя польза назначения любых АМП при бессимптомной бактериурии в клинических исследованиях не доказана [7, 11]. Несомненно также, что ухудшению ситуации с антибиотикорезистентностью способствовало широкое необоснованное применение АМП, в том числе препаратов группы фторхинолонов, в период пандемии COVID-19 [12, 14].
Отдельного внимания заслуживает динамика устойчивости к фосфомицину. В отличие от данных, полученных в исследовании «ДАРМИС-2018», а также в ряде других исследований, результаты проведенного нами анализа показали значимое снижение чувствительности E. coli к этому препарату. При этом число резистентных штаммов возбудителя за четыре года увеличилось более чем в 2 раза: с 14,6 % до 34,1 %. Фосфомицин в настоящее время согласно российским клиническим рекомендациям является препаратом выбора для лечения острого цистита. Но при назначении антимикробной терапии врачу необходимо учитывать особенности лекарственной устойчивости в нашем регионе. К сожалению, выявленный в нашем исследовании уровень резистентности E. coli к фосфомицину не позволяет специалистам медицинских организаций Иркутской области рекомендовать данный препарат для лечения острого цистита без подтвержденной чувствительности возбудителя. Препаратами выбора в таких случаях следует считать нитрофураны, сохраняющие высокую активность в отношении E. coli.
В то же время при инфекциях верхних отделов мочевыводящих путей выбор адекватной стартовой терапии представляется более сложной задачей. В настоящее время ципрофлоксацин и левофлоксацин остаются препаратами выбора в терапии острого пиелонефрита как в амбулаторных, так и в стационарных условиях. Но с учетом уровня резистентности E. coli к фторхинолонам вероятность неудачи эмпирической терапии крайне высока. Назначение цефалоспоринов III, которые также рекомендуются для стартовой терапии пиелонефритов, не будет иметь преимуществ, поскольку уровень резистентности возбудителя к ним также высок, а частота встречаемости продуцентов БЛРС среди штаммов E. coli делает прогноз в отношении применения цефалоспоринов III неутешительным. В таких случаях следует рассматривать возможность более широкого использования других групп АМП, таких как аминогликозиды. Аминогликозиды создают высокие концентрации в моче и могут назначаться при нетяжелых ИМП как в качестве монотерапии, так и в комбинации с бета-лактамами. При тяжелом течении пиелонефрита препаратами выбора остаются карбапенемы.
Таким образом, с учетом данных мониторинга антибиотикорезистентности в медицинской организации необходим регулярный пересмотр локальных протоколов антимикробной терапии, обязательных для выполнения каждым лечащим врачом учреждения. Однако, принимая решение о назначении стартовой терапии ИМП врач должен учитывать факторы риска антибиотикорезистентности у конкретного пациента, в том числе предшествующие курсы антибактериальной терапии.
Заключение
В настоящее время выбор стартовой терапии ИМП представляется сложной задачей, так как спектр антимикробных препаратов, стандартно применяемых при лечении этих инфекций, весьма ограничен, а уровень устойчивости к ним ведущих уропатогенов очень высокий. В условиях значительного роста резистентности E. coli к препаратам первой линии представляется целесообразным использование для эмпирической терапии ИМП антибактериальных средств других групп.
Результаты проведенного нами исследования подтверждают необходимость усиления контроля за применением антибактериальных средств в медицинских организациях (как на амбулаторном, так и стационарном этапах), а также постоянного микробиологического мониторинга с целью выявления особенностей локальной антибиотикорезистентности и актуализации протоколов эмпирической терапии ИМП. Необходимы дальнейшие мероприятия по повышению компетентности медицинских специалистов в вопросах рационального использования АМП, повышению их приверженности следованию протоколам антибактериальной терапии, утвержденных на локальном уровне.
Список литературы
1. Павлов В.Н., Пушкарев А.М., Галимзянов В.З. и др. Инфекции мочевых путей: учебное пособие. 2-е изд., перераб. и доп. Уфа: ФГБОУ ВО БГМУ Минздрава России; 2020 [Pavlov V.N., Pushkarev A.M., Galimzyanov V.Z. and al. Urinary tract infections: a study guide. 2nd ed., revised. and additional. Ufa: BSMU; 2020 (In Russian)].
2. Палагин И.С., Сухорукова М.В., Дехнич А.В. и соавт. Исследовательская группа «ДАРМИС». Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010-2011). Клиническая микробиология и антимикробная химиотерапия. 2012;14(4):280-302 [Palagin I.S., Sukhorukova M.V., Dekhnich A.V., et al. DARMIS Study Group. Current state of antibiotic resistance of pathogens causing community-aquired urinary tract infections in Russia: “DARMIS” Study (2010-2011). Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2012;14(4):280-302 (In Russian)]. https://cmac-journal.ru/publication/2012/4/cmac-2012-t14-n4-p280/cmac-2012-t14-n4-p280.pdf [дата доступа: 09.10.2023]
3. Палагин И.С., Сухорукова М.В., Дехнич А.В. и др. Исследовательская группа «ДАРМИС-2018». Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018». Клиническая микробиология и антимикробная химиотерапия. 2019;21(2):134–146 [Palagin I.S., Sukhorukova M.V., Dekhnich A.V. et al. «DARMIS-2018 Study Group. Antimicrobial resistance of pathogens causing community-aquired urinary tract infections in Russia: results of multicenter study «DARMIS-2018». KMAKH 2019;21(2):134–146 (In Russian)]. DOI:10.36488/cmac.2019.2.134-146
4. Яковлев С.В., Суворова М.П. Нозокомиальные инфекции мочевыводящих путей. Урология. 2016;(S3):45-64 [Yakovlev S.V., Suvorova M.P. Nosocomial urinary tract infections. Urology. 2016;(S3):45-64 (In Russian)]. https://urologyjournal.ru/ru/archive/article/33329 [дата доступа: 09.10.2023]
5. Рафальский В.В., Малеев И.В., Рохликов И.М. и др. Рациональная антибактериальная терапия амбулаторных инфекций мочевыводящих путей с учетом данных по резистентности основных уропатогенов в России. Трудный пациент. 2006;9:25–31 [Rafalsky V.V., Maleev I.V., Rokhlikov I.M. and others. Rational antibacterial therapy of outpatient urinary tract infections taking into account data on the resistance of the main uropathogens in Russia. Difficult patient. 2006;9:25–31(In Russian)]. https://cyberleninka.ru/article/n/ratsionalnaya-antibakterialnaya-terapiya-ambulatornyh-infektsiy-mochevyvodyaschih-putey-s-uchetom-dannyh-po-rezistentnosti-osnovnyh [дата доступа 09.10.2023]
6. Рафальский В.В., Моисеева Е.М. Эпидемиология неосложненных внебольничных инфекций мочевыводящих путей в Российской Федерации. Вестник урологии. 2018;6(2):30-37 [Rafalsky V.V., Moiseeva E.M. Epidemiology of uncomplicated outpatient urinary tract infections in the Russian Federation. Urology Herald. 2018;6(2):30-37 (In Russian)]. DOI:10.21886/2308-6424-2018-6-2-30-37.
7. Finucane TE. "Urinary Tract Infection"-Requiem for a Heavyweight. J Am Geriatr Soc. 2017;65(8):1650-1655. DOI:10.1111/jgs.14907
8. Козлов Р.С., Голуб А.В. Современные аспекты выбора антимикробных препаратов при неосложненных инфекциях мочевых путей. Амбулаторная хирургия. 2015;(1-2):47-54 [Kozlov R.S., Golub A.V. Modern aspects of the choice of antimicrobial drugs for uncomplicated urinary tract infections. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2015;(1-2):47-54 (In Russian)]. https://www.a-surgeon.ru/jour/article/view/9/10 [дата доступа: 09.10.2023]
9. Яковлев С.В., Суворова М.П. Обоснование выбора антибиотика для лечения цистита: рекомендации клинических фармакологов. Обзор литературы. Терапевтический архив. 2022;94(8):1006–1013 [Yakovlev SV, Suvorova MP. Rationale for choosing an antibiotic for the treatment of cystitis: recommendationsw of clinical pharmacologists: A review. Terapevticheskii Arkhiv (Ter. Arkh.). 2022;94(8):1006–1013 (In Russian)]. DOI: 10.26442/00403660.2022.08.201775
10. Захарова И.Н., Османов И.М., Мачнева Е.Б. и др. От бактериурии до микробиома мочевых путей: эволюция взглядов ученых и клиницистов. Медицинский Совет. 2018;(17):168-177 [Zakharova I.N., Osmanov I.M., Machneva E.В. et al. From bacteriuria to the urinary tract microbiome: the evolution of the views of researchers and clinicians. Meditsinskiy sovet = Medical Council. 2018;(17):168-177 (In Russian)]. DOI: 10.21518/2079-701X-2018-17-168-176
11. Mody L, Juthani-Mehta M. Urinary tract infections in older women: a clinical review. JAMA. 2014;311(8):844-854. DOI:10.1001/jama.2014.303
12. Карноух К.И., Лазарева Н.Б. Анализ потребления антибактериальных средств на фоне пандемии COVID-19: уровень стационара. Медицинский Совет. 2021;(16):118-128 [Karnoukh K.I., Lazareva N.B. Analysis of the antibiotic consumption on the backdrop of the COVID-19 pandemic: hospital level. Meditsinskiy sovet = Medical Council. 2021;(16):118-128 (In Russian)]. DOI:10.21518/2079-701X-2021-16-118-128
Об авторах
Наталья Анатольевна ДвойниковаРоссия
Наталья Юрьевна Алексеева
Россия
Иван Дмитриевич Зарва
Россия
Дополнительные файлы
Рецензия
Для цитирования:
Двойникова Н.А., Алексеева Н.Ю., Зарва И.Д. АНАЛИЗ ДИНАМИКИ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ УРОПАТОГЕНОВ У ПАЦИЕНТОВ В МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ. Байкальский медицинский журнал. 2023;2(4):45-52. https://doi.org/10.57256/2949-0715-2023-4-45-52
For citation:
Dvoynikova N., Alekseeva N., Zarva I. ANALYSIS OF THE DYNAMICS OF UROPATHOGENS ANTIMICROBIAL RESISTANCE IN PATIENTS OF MULTI-SPECIALTY HOSPITAL. Baikal Medical Journal. 2023;2(4):45-52. (In Russ.) https://doi.org/10.57256/2949-0715-2023-4-45-52
















