Перейти к:
ЭКСПРЕССИЯ ГЕНОВ ЙОДТИРОН-ДЕЙОДИНАЗ 1, 2 И 3 ТИПОВ, ЙОДТИРОЗИН-ДЕЙОДИНАЗЫ, РЕЦЕПТОРА ТИРЕОИДНЫХ ГОРМОНОВ АЛЬФА И БЕТА И АЦЕТИЛТРАНСФЕРАЗ 1 И 2 ТИПА У БОЛЬНЫХ С ЭУТИРЕОИДНЫМ И ТОКСИЧЕСКИМ ЗОБОМ В ИРКУТСКОЙ ОБЛАСТИ
Аннотация
Актуальность. Патология щитовидной железы продолжать занимать лидирующую позицию в структуре эндокринных заболеваний. С учетом современных требований персонализированного подхода медицины появляется необходимость исследований экспрессии генов, участвующих в иммунорегуляции и биосинтезе тиреоидных гормонов.
Цель. Изучить особенности экспрессии генов йодтирон-дейодиназ 1, 2 и 3 типов, йодтирозин-дейодиназы, рецептора тиреоидных гормонов альфа и бета и ацетилтрансфераз 1 и 2 типа в образцах ткани щитовидной железы у больных, оперированных по поводу эутиреоидного и токсического зоба.
Материалы и методы. В одноцентровое исследование включены 32 пациента, проживающие на территории Иркутской области, которые в течение 2021–2023 гг. прооперированы в объеме тиреоидэктомии по поводу доброкачественных заболеваний щитовидной железы: 12 – с диффузным токсическим зобом, 9 – с многоузловым токсическим зобом и 11 – с многоузловым эутиреоидным зобом.
Результаты. В тканях щитовидной железы выявлена активная экспрессия генов йодтиронин-дейодиназы III типа и йодтирозин-дейодиназы. При многоузловом токсическом зобе более высокая экспрессия йодтиронин-дейодиназы III типа выявляется у больных с развитием послеоперационного пареза гортани (p=0,05). Размеры щитовидной железы при многоузловом эутиреоидном зобе согласуются с экспрессией рецепторов, определяющих метаболизм йодтиронинов: при токсическом – с экспрессией рецептора тиреоидных гормонов бета, при эутиреоидном – с геном йодтиронин-дейодиназы I типа (p <0,05). При многоузловом токсическом зобе экспрессия рецептора тиреоидных гормонов альфа отсутствовала реже, чем при диффузном токсическом зобе (р=0,005) и многоузловом эутиреоидном зобе (p=0,0003), что указывает на взаимосвязь экспрессии рецептора тиреоидных гормонов альфа развитием неимунного тиреотоксикоза. При всех вариантах заболевания экспрессируется ацетилтрансфераза 2 типа, при этом экспрессия ацетилтрансферазы 1 типа выявляется реже.
Заключение. Исследование демонстрирует особенности экспрессии генов йодтирон-дейодиназ 1, 2 и 3 типов, йодтирозин-дейодиназы, рецептора тиреоидных гормонов альфа и бета и ацетилтрансфераз 1 и 2 типа в образцах ткани щитовидной железы у больных, оперированных по поводу эутиреоидного и токсического зоба. Показаны взаимосвязи отдельных генов с особенностями течения заболевания и осложнениями.
Для цитирования:
Ильичева Е.А., Родионова Л.В., Самойлова Л.Г., Рой Т.А., Берсенев Г.А. ЭКСПРЕССИЯ ГЕНОВ ЙОДТИРОН-ДЕЙОДИНАЗ 1, 2 И 3 ТИПОВ, ЙОДТИРОЗИН-ДЕЙОДИНАЗЫ, РЕЦЕПТОРА ТИРЕОИДНЫХ ГОРМОНОВ АЛЬФА И БЕТА И АЦЕТИЛТРАНСФЕРАЗ 1 И 2 ТИПА У БОЛЬНЫХ С ЭУТИРЕОИДНЫМ И ТОКСИЧЕСКИМ ЗОБОМ В ИРКУТСКОЙ ОБЛАСТИ. Байкальский медицинский журнал. 2025;4(4).
For citation:
Ilyicheva E., Rodionova L., Samoilova L., Roy T., Bersenev G. EXPRESSION OF GENES OF IODOTHYRONINE DEIODINASES TYPES 1, 2 AND 3, IODOTYROSINE DEIODINASE, THYROID HORMONE RECEPTOR ALPHA AND BETA AND ACETYLTRANSFERASES TYPES 1 AND 2 IN PATIENTS WITH EUTHYROID AND TOXIC GOITER IN THE IRKUTSK REGION. Baikal Medical Journal. 2025;4(4).
Актуальность
Патология щитовидной железы (ЩЖ) продолжает занимать лидирующую позицию в структуре эндокринных заболеваний после сахарного диабета [1]. По данным Национального медицинского исследовательского центра эндокринологии, заболеваемость узловым зобом составляет от 5,2 до 70 %, а диффузным токсическим - от 2 до 5 % в зависимости от региона России [2]. Многоузловой зоб диагностируют у 5 % населения не эндемичных и у 15 % — эндемичных регионов планеты [3]. Тиреоидэктомия остается методом выбора при большом зобе, осложненном компрессионным синдромом, при сопутствующем первичном гиперпаратиреозе или раке ЩЖ, при развитии побочных эффектов тиреостатиков и отсутствии возможности проведения терапии радиоактивный йодом [4].
С учетом современных требований персонализированного подхода медицины появляется необходимость исследований по оптимизации стратегий лечения пациентов с учётом особенностей экспрессии генов, участвующих в иммунорегуляции и биосинтезе тиреоидных гормонов. Наиболее перспективными из них являются: йодтиронин-дейодиназа 1, 2 и 3 типов, йодтирозин-дейодиназа, рецептор тиреоидных гормонов альфа и бета, ацетилтрансфераза 1 и 2 типа [5].
Йодтиронин-дейодиназа I типа (DIO1) – это фермент, который катализирует удаление атома йода c внутреннего или внешнего кольца гормона тироксина (T4) с образованием трийодтиронина (T3). Ген, кодирующий этот фермент, в основном экспрессируется в печени и почках, обеспечивая приблизительно 30-40 % внетиреоидной продукции Т3. Йодтиронин-дейодиназа II типа (DIO2) – фермент, катализирующий дейодирование T4 по внешнему кольцу. Её ген широко экспрессируется в различных органах, в том числе в щитовидной железе и мозге. Он отвечает за «локальную» выработку Т3 и играет роль в воздействии гормонов щитовидной железы на эти ткани. Йодтиронин-дейодиназа III типа (DIO3) – катализирует инактивацию гормонов щитовидной железы путём дейодирования внутреннего кольца T4 и T3 до неактивных метаболитов [6,7,8,9,10,11]. Йодтирозин-дейодиназа (IYD) - фермент, запускающий окислительное НАДФН-зависимое дейодирование моно- и дийодтирозина. Ген IYD очень мало изучен, а мутации в нём вызывают врождённый гипотиреоз [12,13,14]. Рецептор тиреоидных гормонов альфа и бета (TRα и TRβ) - ядерные рецепторы трийодтиронина, обеспечивающие его биологическую активность [15,16,17]. N-ацетилтрансфераза 1 и 2 (NAD 1 и 2) – ферменты ацетилирования ряда ксенобиотиков, фенотипические изменения которых связаны с восприимчивостью к неоплазии, резистентностью к инсулину и метаболическим нарушениям [18,19].
Цель исследования
Изучить особенности экспрессии генов йодтирон-дейодиназ 1, 2 и 3 типов, йодтирозин-дейодиназы, рецептора тиреоидных гормонов альфа и бета и ацетилтрансфераз 1 и 2 типа в образцах ткани щитовидной железы у больных, оперированных по поводу эутиреоидного и токсического зоба, и их роль в развитии осложнений заболевания и операции.
Материалы и методы
Клиническое исследование проведено с 2021 по 2023 г. на базе отделения торакальной хирургии Иркутской ордена «Знак почета» областной клинической больницы (ИОКБ). Исследование экспрессии генов DIO 1,2,3, IYD, TRα и TRβ, NAD 1 и 2 проведено с 2021 по 2023 г. на базе лаборатории клеточной патофизиологии и биохимии Иркутского научного центра хирургии и травматологии.
В одноцентровое наблюдательное проспективное исследование с ретроспективным сбором данных включены пациенты европеоидной расы, проживающие на территории Иркутской области, которые в течение 2021 -2023 гг. прооперированы в объеме тиреоидэктомии по поводу многоузлового эутиреоидного зоба с развитием компрессионного синдрома шеи, многоузлового токсического зоба с декомпенсированной функциональной автономией железы и диффузного токсического зоба в случаях непереносимости тиреостатической терапии, рецидиве тиреотоксикоза при отказе от лечения радиоактивным иодом.
Критерии включения: рецидив тиреотоксикоза; непереносимость тиреостатической терапии; наличие декомпенсированной функциональной автономии щитовидной железы сдавление органов шеи увеличенной щитовидной железой.
Критерии исключения: отказ больного от исследования; возраст младше 18 лет и старше 80 лет; односторонняя операция на щитовидной железе; наличие смежной патологии околощитовидных желез, требующих хирургической коррекции; злокачественные новообразования щитовидной железы.
В соответствии с критериями в исследование включены 32 пациента с доброкачественными заболеваниями щитовидной железы (30 женщин и двое мужчин). Медиана возраста составила 55 (46-63) лет.
В ходе исследования больные ранжированы на три группы в зависимости от установленного диагноза: 1 - диффузный токсический зоб (ДТЗ) (n=12), 2 – многоузловой токсический зоб (МУТЗ) (n=9) и 3 - многоузловой зоб без тиреотоксикоза (МУЗ) (n=11). Осложнение заболевания в виде тиреотоксического сердца (фибрилляция предсердий) выявлено у восьми пациентов; сдавление органов шеи (трахеи и пищевода) – у 24. Эндокринная офтальмопатия (по шкале CAS (clinical activity score) <3) установлена у восьми пациентов. Непереносимость тиреостатической терапии, проявляющаяся в развитии нейтропении (снижение уровня нейтрофилов ниже 1500 в 1 мкл периферической крови), отмечена у двух больных.
Всем больным выполнено стандартное для тиреоидной патологии клинико-лабораторное и инструментальное обследование (общий и биохимический анализ крови, мочи, основные показатели гемостаза, ультразвуковое исследование щитовидной железы, рентгенологическое обследование для выявления сдавления органов шеи, оценка гормональной активности по уровню кальцитонина крови, тиреоторопного гормона (ТТГ) гипофиза и свободного тироксина, антител к рецепторам ТТГ и сцинтиграфии щитовидной железы с технецием-пертехнетатом при тиреотоксикозе). Изучали анамнестические данные и результаты объективного осмотра. Хирургические вмешательства выполнялись хирургами отделения торакальной хирургии ИОКБ с соблюдением принципа визуального контроля сохранности возвратных гортанных нервов и околощитовидных желез, дренирования зоны операции. Оценивали течение послеоперационного периода до выписки больного из стационара с обязательным проведением исследования подвижности голосовых складок (ларингоскопия) и уровня кальция крови. Все полученные данные вносили в статистические таблицы.
Для исследования особенностей экспрессии генов DIO 1,2,3, IYD, TRα и TRβ, NAD 1 и 2 использовали метод полимеразной цепной реакции в реальном времени (real time ПЦР).
Образцы ткани ЩЖ отбирали во время операции: при многоузловой зобе из узловых образований с захватом окружающей ткани, при диффузном токсическом – из толщи патологической ткани случайным образом. Их помещали в раствор, предотвращающий гидролиз нуклеиновых кислот (фиксатор для стабилизации РНК в биологических образцах, кат. ВС031, Евроген, Россия). Затем полученную ткань замораживали в жидком азоте, измельчали в ступке, гомогенизировали до однородного состояния в буфере с добавлением ингибитора рибонуклеаз и выделяли суммарную рибонуклеиновую кислоты (РНК) с помощью реагента «ExTRαct RNA для выделения суммарной РНК из биологических образцов» (кат. ВС032, Евроген, Россия).
Поскольку для выделения РНК в данном наборе использован токсичный реагент (фенол + гуанидин-изотиоцианат), перед работой предварительно готовили раствор для его нейтрализации, который использовали для обезвреживания и утилизации образующихся отходов: водный раствор 0,1М гидроксида натрия или пищевой соды (NaHCO3) - экспозиция 10 минут при заливании отходы/раствор в соотношении 1:1.
После диссоциации нуклеопротеидных комплексов нерастворимые фрагменты удаляли с помощью центрифугирования. В случае образования жировой пленки на поверхности супернатанта, отбирали жидкость, не захватывая ее. Экстракцию проводили с помощью хлороформа. Для улучшения выхода РНК в водную фазу добавляли 5 мкг соосадителя нуклеиновых кислот Satellite Red (Евроген, кат. №ВС001). Осаждение производили с помощью 75 % этанола, осадок высушивали и растворяли в воде, свободной от РНКаз.
Полученные образцы РНК обрабатывали дезоксирибонуклеазой, а затем подвергали дополнительной очистке набором «Clean RNA Standart для очистки РНК на колонках» (кат. ВС033, Евроген, Россия) для концентрирования и очистки от низкомолекулярных фракций (размером менее 200 нуклеотидов), в том числе от транспортной РНК. Полученный препарат РНК аликвотировали.
С использованием очищенной РНК ставили реакцию обратной транскрипции для получения комплементарной дезоксирибонуклеиновой кислоты (кДНК) (Набор «MMLV RT Kit для синтеза кДНК», кат. SK021, Евроген, Россия). Реакционная смесь содержала по 10 мкл ММХ, 1 мкл ревертазы, 1 мкл праймеров Random-6 и 3 мкл воды на каждые 10 мкл РНК конкретного пациента. Дополнительно ставили отрицательный контрольный образец обратной транскрипции. Пробирки помещали в твердотельный термостат «Термит» (Россия) и выдерживали следующую программу температурно-временного режима: 37°С 30 минут, 92°С – 5 минут. Полученную после этого этапа кДНК сразу использовали для постановки ПЦР или хранили при -20°С.
На следующем этапе ставили real time ПЦР со специфическими зондами из сделанного по индивидуальному заказу набора реагентов производства Синтол (Россия) для определения экспрессии генов DIO1, DIO2, IYD, TRα и TRβ. Реакционная смесь для ПЦР содержала по 10 мкл ММХ, 1 мкл Taq-полимеразы, 1 мкл смеси праймеров и зонда и 9 мкл воды на каждые 4 мкл кДНК для определения экспрессии одного гена. Экспрессию генов NAT1 и NAT2 определяли с помощью специфичных праймеров RealTimePrimers.com, готовой смеси для ПЦР (Евроген) и интеркалирующего красителя SYBR, в остальном процедура была такой же, как и для предыдущих 6-ти генов. В каждой постановке использовали отрицательные контроли выделения, обратной транскрипции и ПЦР. Для проведения амплификации и измерения флуоресцентного сигнала использовали амплификатор CFX96 (Bio Rad, США). Программа амплификации представлена в таблице 1.
Таблица 1. Программа амплификации
Table 1. Amplification program
Температура | Время | Количество циклов |
95°С | 3 мин. | 1 |
95°С | 0:10 | 50 |
63°С + READ по каналу FAM | 0:40 |
Этическая экспертиза. Все пациенты подписали информированное согласие на участие в исследовании.
Статистический анализ. Статистический анализ проводили с помощью пакета программ Statistica 10.0 for Windows (лицензия №AXAR402G263414FA-V). Выполнялся описательный и сравнительный анализ с использованием методов непараметрической статистики. Непрерывные данные представляли в виде медианы с нижним и верхним квартилями, категориальные – в виде числа наблюдений и частоты в процентах. Определение статистической значимости различий для непрерывных данных (р) в сравниваемых выборках проведено по критериям Манна–Уитни (U). Корреляционный анализ выявленных статистически значимых параметров проведен на основе ранговых корреляций Спирмена.
Результаты
Показатели экспрессии дейодиназ в ткани щитовидной железы представлены в таблице 2.
Таблица 2. Показатели экспрессии дейодиназ в ткани щитовидной железы
Table 2. Deiodinase expression indices in thyroid tissue
| ДТЗ | МУТЗ | МУЗ |
N набл. | 12 | 9 | 11 |
DIO1 | 100 (59;100) | 100 (36;100) | 100 (100;100) |
DIO2 | 100 (37;100) | 38 (33;100) | 100 (37;100) |
DIO3 | 32 (30;34) | 30 (29;33) | 33 (29;36) |
IYD | 37 (35;41) | 35 (31;36) | 37 (34;39) |
TRα | 100 (100;100) | 36 (35;40) | 100 (100;100) |
TRβ | 38 (31;75) | 51 (37;100) | 68 (37;100) |
Примечание: чем больше значение показателя (время появления), тем ниже экспрессия; 100 – отсутствие экспрессии.
При ДТЗ отсутствие экспрессии DIO1 установлено у 8 больных (67 %); отсутствие экспрессии DIO2 у 7 больных (58 %); экспрессия DIO3 выявлялась во всех случаях; отсутствие экспрессии IYD в 2 случаях (17 %); отсутствие экспрессии TRα у 10 пациентов (83 %); отсутствие экспрессии TRβ отмечалась у 3 пациентов (25 %). Сравнение экспрессии дейодиназ в зависимости от наличий эндокринной офтальмопатии показало отсутствие различий экспрессии TRβ (pU=1). Сравнение экспрессии дейодиназ в зависимости от наличия тиреотоксического сердца показало отсутствие различий в DIO3 и TRβ (pU=1). Тиреотоксическое сердце при ДТЗ развивается не зависимо от экспрессии DIO3 и TRβ (pU>0,95). Развитие такого осложнения при ДТЗ как тиреотоксическое сердце никак не было связано с экспрессией изучаемых генов. Что легко объяснимо тем, что локальная экспрессия в тканях щитовидной железы никак не может повлиять на общую избыточную концентрацию йодтиронинов и их стимулирующее действие на кардиомиоциты.
При сравнении экспрессии в зависимости от пола установлено более высокие значения у мужчин для DIO3 (pU=0,06) и IYD (pU=0,03) (таблица 3).
Таблица 3. Показатели экспрессии DIO3 и IYD в образцах ткани щитовидной железы при ДТЗ в зависимости от пола
Table 3. Gender-specific expression levels of DIO3 and IYD in thyroid tissue samples with DTG
Мужчины | Женщины | |||||||
N набл. | Медиана | Нижний квартиль | Верхний квартиль | N набл. | Медиана | Нижний квартиль | Верхний квартиль | |
DIO3 | 2 | 29 | 29 | 30 | 10 | 33 | 31 | 35 |
IYD | 2 | 31 | 30 | 33 | 10 | 38 | 36 | 43 |
При МУТЗ отсутствие экспрессии DIO1 установлено у 5 пациенток (56 %); отсутствие экспрессии DIO2 у 3 (33 %); отсутствия экспрессии DIO3 и IYD не выявлялось; отсутствие экспрессии TRα - у 2 пациентов (22 %); отсутствие экспрессии TRβ отмечалась в 4 случаях (44 %). При данной форме заболевания экспрессия TRα отсутствовала реже, чем при ДТЗ (рU=0,005), остальные частоты различались незначимо. Полученная зависимость показывает связь экспрессии TRα с неимунным тиреотоксикозом. Выявлена сопряженность между экспрессией TRβ и массой удаленной щитовидной железы (n=9; R=-0,65; p=0,04) – чем ниже экспрессия (более длительное время ее проявления), тем меньше масса органа. При оценке особенностей течения послеоперационного периода выявлена более высокая экспрессия DIO3 у больных с развитием послеоперационного пареза гортани (рисунок 1).

Рис. 1. Экспрессия DIO3 в ткани ЩЖ у больных токсическими формами зоба в зависимости от наличия послеоперационного пареза гортани.
Fig. 1. Expression of DIO3 in thyroid tissue in patients with toxic forms of goiter depending on the presence of postoperative laryngeal paresis.
При МУЗ отсутствие экспрессии DIO1 установлено у 9 больных (82 %), отсутствие экспрессии DIO2 у 6 больных (55 %),отсутствие экспрессии DIO3 выявлялась в одном случае (9 %); отсутствие экспрессии IYD в 2 случаях (18 %); отсутствие экспрессии TRα у всех пациентов (100 %), отсутствие экспрессии TRβ отмечалось у 5 пациентов (45 %).
Частота отсутствия экспрессии TRα статистически значимо различалась с МУТЗ (pU=0,0003). Различия с ДТЗ оказались не значимы. Полученные данные подтверждают взаимосвязь экспрессии TRα при зобе с развитием неимунного тиреотоксикоза. Кроме того, при МУЗ выявлена сопряженность объема ЩЖ, оцененного по данным дооперационной ультрасонографии и экспрессии DIO1 (n=9; R=-0,73; p=0,02) - чем меньше объем, тем ниже экспрессия DIO1 в ткани ЩЖ.
Показатели экспрессии NAT1 и NAT2 в ткани щитовидной железы представлены в таблице 4.
Таблица 4. Экспрессия генов NAT1 и NAT2 в ткани щитовидной железы у пациентов с ДТЗ
Table 4. NAT1 and NAT2 Gene Expression in Thyroid Tissue in Patients with DTG
| ДТЗ | МУТЗ | МУЗ |
N набл. | 7 | 6 | 6 |
NAT1 | 100 (24;100) | 100 (100;100) | 100 (100;100) |
NAT2 | 47 (46;51) | 50 (49;51) | 50 (45;50) |
Примечание: чем больше значение показателя (время появления), тем ниже экспрессия; 100 – отсутствие экспрессии.
При ДТЗ отсутствие экспрессии NAT1 в образцах ткани ЩЖ установлено у 4 больных (57 %), NAT2 – 0 (pU=0,02). При МУТЗ отсутствие экспрессии NAT1 в образцах ткани ЩЖ у 5 больных (83 %), NAT2 – 0 (p=0,003). В сравнении с ДТЗ различия не значимы. Частота развития тиреотоксического сердца у больных этой формой заболевания при отсутствии экспрессии NAT1 составила 33%, при сохранении 0, различия не значимы. Частота развития нейтропении при сохранении экспрессии NAT1 составила – 25 %, при сохранении – 11 %, различия не достигали статистической значимости. При МУЗ отсутствие экспрессии NAT1 в образцах ткани ЩЖ установлено у 6 больных (100 %), NAT2 – у 0 (0 %) (pU=0,0005). Частота выявления экспрессии NAT1 при нетоксических формах зоба снизилась статистически не значимо в сравнении с больными, имеющими тиреотоксикоз.
Таким образом, установлены различия в экспрессии NAT1 и NAT2 в тиреоидной ткани у больных с доброкачественными заболеваниями щитовидной железы. NAT2 экспрессируется у всех больных, NAT 1 – менее чем в половине образцов.
При проведении корреляционного анализа выявлена согласованность экспрессии гена TRα, кодирующего рецепторы к тиреоидным гормонам альфа и NAT2 – (выявлена тесная отрицательная связь NAT2 и TRα) и тесная положительная зависимость между IYD и TRα при МУТЗ, и тесная положительная зависимость между IYD и DIO2 при ДТЗ (таблица 5).
Таблица 5. Сопряженность экспрессии генов в ткани ЩЖ при доброкачественных заболеваниях.
Table 5. Conjugacy of gene expression in thyroid tissue in benign diseases.
Сопряженные пары | NAT2 TRα | TRα NAT1 | IYD DIO2 | TRα DIO1 | IYD DIO1 | IYD TRα | DIO3 IYD |
При всех заболеваниях | |||||||
n | - | 19 | 34 | 34 | 34 | 34 | - |
R | - | -0,01 | 0,51 | 0,45 | 0,41 | 0,39 | - |
p. | - | 0,9691 | 0,002 | 0,0079 | 0,0165 | 0,0227 | - |
ДТЗ | |||||||
n | - | - | 12 | - | - | - | - |
R | - | - | 0,7 | - | - | - | - |
p. | - | - | 0,0108 | - | - | - | - |
МУТЗ | |||||||
n | 6 | - | - | - | - | 9 | 9 |
R | -0,94 | - | - | - | - | 0,81 | 0 |
p. | 0,0048 | - | - | - | - | 0,0079 | 1 |
МУЗ | |||||||
n | - | - | - | - | - | - | - |
R | - | - | - | - | - | - | - |
p. | - | - | - | - | - | - | - |
Примечание: «-» - показатель статистически не значим. R- корреляция Спирмена, n-число наблюдений, p – уровень значимости коэффициента корреляции.
Кроме того, получены данные об отсутствии согласованности изменения экспрессии между DIO3 и IYD при МУТЗ. Экспрессия TRα при доброкачественных заболевания ЩЖ не зависела от экспрессии NAT1 в ткани ЩЖ
На рисунке 2 представлена активность экспрессии исследуемых генов в ткани щитовидной железы пациентов с доброкачественными заболеваниями ЩЖ. Среди пациентов с рассматриваемой патологией наиболее активной экспрессируемым был ген DIO3, а наименее активными – NAT1 и TRα.

Рис. 2. Активность экспрессии исследуемых генов (выраженная в 1/Ct х 1000) в ткани щитовидной железы пациентов с доброкачественными заболеваниями ЩЖ.
Fig. 2. Expression activity of the studied genes (expressed in 1/Ct x 1000) in the thyroid tissue of patients with benign thyroid diseases.
На рисунке 3 представлены диаграммы, дающие совокупную оценку экспрессии всех генов в зависимости от исследуемой группы.
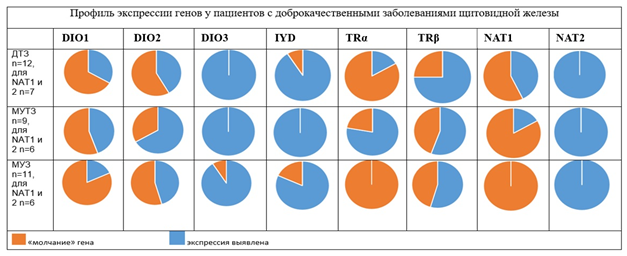
Рис. 3. Суммарная выявляемость экспрессии генов в ткани щитовидной железы пациентов с доброкачественными заболеваниями ЩЖ.
Fig. 3. Total detectability of gene expression in thyroid tissue of patients with benign thyroid diseases.
При проведении общей оценки интенсивности всех исследованных генов (суммарно) выявлено, что больше всего «молчащих» генов было в группе МУЗ, а больше всего активных – в группе МУТЗ. Очевидно, что наибольшая активация экспрессии и интенсификация метаболизма происходит при токсических вариантах зоба. Для выяснения причин и раскрытия механизмов этих явлений необходимы дальнейшие исследования на большем количестве материала.
В таблице 6 представлена частота вариантов профилей экспрессии ключевых факторов периферической конверсии дейодиназ (DIO1, DIO2, DIO3) у пациентов в зависимости от клинического варианта патологии ЩЖ.
Таблица 6. Частота вариантов профилей экспрессии ключевых факторов периферической конверсии дейодиназ (DIO1, DIO2, DIO3) у пациентов в зависимости от клинического варианта патологии ЩЖ.
Table 6. Frequency of expression profile variants of key factors of peripheral conversion of deiodinases (DIO1, DIO2, DIO3) in patients depending on the clinical variant of thyroid pathology.
Группа | DIO1 + DIO2 + DIO3 + | DIO1 + DIO2 + DIO3 - | DIO1 + DIO2 - DIO3 + | DIO1 - DIO2 - DIO3 + | DIO1 + DIO2 - DIO3 - | DIO1 - DIO2 + DIO3 + | DIO1 - DIO2 + DIO3 - | DIO1 - DIO2 - DIO3 - |
ДТЗ (n=12) | 3 (25 %) | 0 | 1 (8,3%) | 6 (50,0%) | 0 | 2 (16,7%) | 0 | 0 |
МУТЗ (n=9) | 3 (33,3%) | 0 | 1 (11,1%) | 4 (44,4%) | 0 | 1 (11,1%) | 0 | 0 |
МУЗ (n-11) | 2 (18,2%) | 0 | 0 | 5 (45,4%) | 0 | 3 (27,3%) | 0 | 1 (9,1%) |
Примечание: DIO + экспрессия выявлена; DIO – молчание гена.
Из таблицы 6 видно, что при ДТЗ и МУТЗ наиболее активный профиль дейодиназ был у 25-33,3 % пациентов, а при МУЗ этот вариант выявлен только у 18,2 % больных. Кроме того, абсолютное «молчание» всех изоферментов дейодиназ (столбец DIO1-/ DIO2-/ DIO3 -) встречалось только в группе с МУЗ.
Обсуждение
Исследование впервые оценивает экспрессию генов йодтирон-дейодиназ 1, 2 и 3 типов, йодтирозин-дейодиназы, рецептора тиреоидных гормонов альфа и бета и ацетилтрансфераз 1 и 2 типа в образцах ткани щитовидной железы у пациентов Иркутской области с эутиреоидным и токсическим зобом, а также показывает его зависимость от клинического варианта и осложнений заболевания.
Впервые выявлена активная экспрессия гена DIO3 и IYD в тканях щитовидной железы человека. Установлено, что при ДТЗ экспрессия DIO3 и IYD у женщин выше, чем у мужчин (p≤0,05).
Опубликованных работ посвящено оценке экспрессии гена DIO3 в различных органах и тканях животных, рыб и птиц и не затрагивают человека.
Так, D. Katarzyńska-Banasik et al., оценивания экспрессию гена DIO3 у кур-несушек породы «Бованс», показали – наибольшая экспрессия определяется в ткани печени, в три раза меньшая в ЩЖ, поджелудочной железе и тонкой кишке [20]. Впервые авторами выявлена экспрессия DIO3 в яичниках, определяя его регуляторную роль в контроле локальной доступности гормонов ЩЖ во время созревания фолликулов. Годом ранее эти же авторы, изучая влияния нано-частиц серебра на метаболизм тиреоидных гормонов, показали повышение концентрации трийодтиронина (Т3) за счёт повышения экспрессии DIO3 в 80 % раз в щитовидной железе, при этом уровни DIO1и DIO2 оставались неизменными [21]. B.J. Przybył et al., оценивая влияние инфузии нейропептида QRFP43 с орексигенными свойствами у самок польских мериносовых овец, показали повышение экспрессии DIO3 в группах овец, которым вводили QRFP43 в концентрации 10 мкг и 50 мкг в сутки, в сравнении с контрольной группой, которой вводили раствор Рингера [22]. M.E. Martinez et al. использовали мышей-самцов породы «Вистер» с дефицитной экспрессией DIO3 в качестве модели тиреотоксикоза и показали, что самки, рожденные от таких самцов, имеют большую массу тела и жировую массу за счёт повышения экспрессия гена лептина и его концентрации в сыворотке крови и снижения экспрессии IYD [23].
При МУТЗ экспрессия TRα выявляется чаще, чем при ДТЗ и МУЗ (p≤0,05). Ранее было показано, что при развитии МУЗ вследствие йодного дефицита, а также при прогрессировании ДТЗ наблюдается снижение экспрессии TRα [24, 25].
Размеры щитовидной железы при многоузловом зобе согласуются с экспрессией рецепторов, определяющих метаболизм йодтиронинов: при МУТЗ - с экспрессией TRβ, при эутиреоидном с DIO1 (p <0,05). При этом снижение экспрессии связано с уменьшением объема ЩЖ. В нескольких исследованиях показано, что снижение экспрессии TRβ проводит к развитию зоба, в том числе токсического, без оценки связи с его размерами [26, 27].
Установлены различия в экспрессии NAT1 и NAT2 в тиреоидной ткани при доброкачественных заболеваниях. При всех вариантах заболевания экспрессируется NAT2, экспрессия NAT 1 выявляется значительно реже при всех вариантах заболевания.
Экспрессия TRα при доброкачественных заболевания ЩЖ не зависима от количества мРНК гена NAT1 в тканях щитовидной железы. При многоузловом токсическом зобе экспрессия TRα отсутствовала реже, чем при ДТЗ (р=0,005) и МУЗ (p=0,0003), что указывает на взаимосвязь экспрессии TRα с развитием неимунного тиреотоксикоза. При МУТЗ выявлена отрицательная корреляция между временем определения экспрессии TRβ и массой удаленной щитовидной железы (n=9; R=-0,65; p=0,04) – чем ниже экспрессия, тем меньше масса органа.
При МУТЗ более высокая экспрессия DIO3 выявляется у больных с развитием послеоперационного пареза гортани DIO3(p=0,05). Кроме того, при МУЗ выявлена сопряженность объема ЩЖ, оцененного по данным дооперационной ультрасонографии и экспрессии DIO1 (n=9; R=-0,73; p=0,02)- чем меньше объем, тем ниже экспрессия DIO1 в ткани ЩЖ.
Для выбора генов-кандидатов мы пользовались результатами L. Fagerberg et al., которые провели анализ экспрессии 3500 генов в различных органах и тканях [28]. В данном анализе изучены четыре образца нормальной ткани ШЖ, экспрессия генов в которых представлена в таблице 7.
Таблица 7. Экспрессия генов в образцах нормальных щитовидных желез (составлена по данным NCBI).
Table 7. Gene expression in normal thyroid samples (compiled according to NCBI data).
Ген | Экспрессия в образцах ЩЖ, RPKM, n=4 |
DIO1 | 178,421±67,084 |
DIO2 | 67,659±21,085 |
DIO3 | Нет данных |
TRα | 11,679±4,499 |
TRβ | 1,375±0,424 |
NAT1 | 0,554±0,3 |
NAT2 | Нет данных |
Примечание: RPKM (reads per kilobase per million mapped reads) – эта единица используется для количественной оценки экспрессии генов с помощью методов секвенирования РНК.
Из данных этой таблицы видно, что наиболее активным геном в ткани щитовидной железы был ген DIO1, в 2,6 раз слабее экспрессировался DIO2, а DIO3 не анализировали. Экспрессия TRα была в 11,67 раз, а TRβ – в 129,7 раз ниже, по сравнению с DIO1. Активность гена NAT1 находилась на низком уровне, а ген NAT2 не был исследован (рисунок 4).
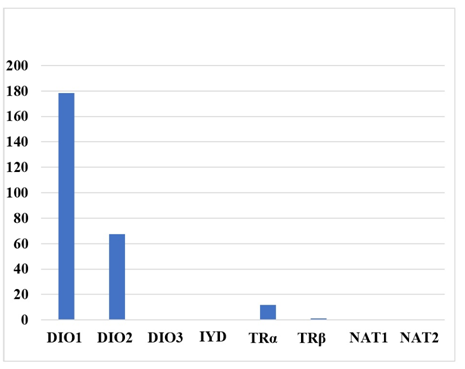
Рис. 4. Экспрессии генов в ткани щитовидной железы методом секвенирования РНК (составлена по данным NCBI)
Fig. 4. Gene expression in thyroid tissue using RNA sequencing (compiled from NCBI data)
По полученному нами профилю экспрессии пациенты с заболеваниями щитовидной железы (рис. 2) кардинально отличались от приведенных данных. Обращает на себя внимание то, что в данной работе активность экспрессии DIO1 в 2,63 раза выше, чем DIO2. В нашем же исследовании, наоборот, DIO2 экспрессировался активнее по сравнению с DIO1 в 1,21 раз. Такие различия могут свидетельствовать об измененном метаболизме йодтиронинов в ЩЖ обследованных пациентов.
Исследование имело ряд ограничений: небольшой размер выборки пациентов и лиц контрольной группы; все исследуемые были жители одного региона.
Заключение
Исследование демонстрирует особенности экспрессии генов йодтирон-дейодиназ 1, 2 и 3 типов, йодтирозин-дейодиназы, рецептора тиреоидных гормонов альфа и бета и ацетилтрансфераз 1 и 2 типа в образцах ткани щитовидной железы у больных, оперированных по поводу эутиреоидного и токсического зоба. Показаны взаимосвязи отдельных генов с особенностями течения заболевания и осложнениями.
Список литературы
1. Якубовский С.В., Кондратенко Г.Г., Салко О.Б. и др. Эпидемиология доброкачественных заболеваний щитовидной железы у взрослого населения Республики Беларусь: анализ общенациональных статистических данных за период 2009–2019 гг. Проблемы эндокринологии. 2022;68(3):30-43 [Yakubovsky S.V., Kondratenko G.G., Salko O.B. et al. Epidemiology of benign thyroid diseases in the adult population of the Republic of Belarus: analysis of national statistical data for the period 2009–2019. Problems of Endocrinology. 2022;68(3):30–43 (In Russ.)]. https://doi.org/10.14341/probl12844
2. Абдулхабирова Ф.М., Безлепкина О.Б., Бровин Д.Н. и др. Клинические рекомендации «Заболевания и состояния, связанные с дефицитом йода». Проблемы эндокринологии. 2021;67(3):10-25 [Abdulkhabirova F.M., Bezlepkina O.B., Brovin D.N. et al. Clinical guidelines “Diseases and conditions associated with iodine deficiency”. Problems of Endocrinology. 2021;67(3):10–25 (In Russ.)]. https://doi.org/10.14341/probl12750
3. Unlu M.T., Kostek M., Aygun N. et al. Non-Toxic Multinodular Goiter: From Etiopathogenesis to Treatment. Sisli Etfal Hastan Tip Bul. 2022;56(1):21-40. https://doi.org/10.14744/SEMB.2022.56514
4. Решетов И.В., Романчишен А.Ф., Вабалайте К.В. и др. Консенсус по лечению больных узловым/ многоузловым зобом. Голова и шея. Российский журнал. 2023;11(3):77–84 [Reshetov I.V., Romanchishen A.F., Vabalajte K.V. et al. Consensus on the Treatment of Patients with Nodular/ Multinodular Goiter. Head and neck. Russian Journal. 2023;11(3):77-84 (In Russ.)]. https://doi.org/10.25792/HN.2023.11.3.77-84
5. Sayers E.W., Bolton E.E., Brister J.R. et al. Database resources of the national center for biotechnology information. Nucleic Acids Res. 2022;50(D1):D20-D26. https://doi.org/10.1093/nar/gkab1112
6. Sabatino L., Vassalle C., Del Seppia C. et al. Deiodinases and the Three Types of Thyroid Hormone Deiodination Reactions. Endocrinology and Metabolism (Seoul). 2021;36(5):952-964. https://doi.org/10.3803/EnM.2021.1198
7. Towell H., Braun D., Brol A. et al. Structural Insights into the Iodothyronine Deiodinase 2 Catalytic Core and Deiodinase Catalysis and Dimerization. Biomolecules. 2024;14(11):1373. https://doi.org/10.3390/biom14111373
8. Marsan E.S., Dreab A., Bayse C.A. In silico insights into the dimer structure and deiodinase activity of type III iodothyronine deiodinase from bioinformatics, molecular dynamics simulations, and QM/MM calculations. Journal of Biomolecular Structure and Dynamics. 2023;41(11):4819-4829. https://doi.org/10.1080/07391102.2022.2073271
9. Mohmmed A.H., Hoshi B., Jubair S. Deiodinase Type 3 Polymorphism (rs1190716) Affects Therapeutic Response to Levothyroxine. Turkish Journal Pharmaceutical Sciences. 2023;20(5):335-340. https://doi.org/10.4274/tjps.galenos.2022.04876
10. Köhrle J., Frädrich C. Deiodinases control local cellular and systemic thyroid hormone availability. Free Radical Biology Medicine. 2022;193(1):59-79. https://doi.org/10.1016/j.freeradbiomed.2022.09.024
11. Yao B., Yang C., Pan C. et al. Thyroid hormone resistance: Mechanisms and therapeutic development. Molecular and Cellular Endocrinology. 2022;553:111679. https://doi.org/10.1016/j.mce.2022.111679
12. Kozyryev A., Lemen D., Dunn J. et al. Substrate Electronics Dominate the Rate of Reductive Dehalogenation Promoted by the Flavin-Dependent Iodotyrosine Deiodinase. Biochemistry. 2023;62(7):1298-1306. https://doi.org/10.1021/acs.biochem.3c00041
13. Olker J.H., Korte J.J., Haselman J.T. et al. Cross-species comparison of chemical inhibition of human and Xenopus iodotyrosine deiodinase. Aquatic Toxicology.2022;249:106227. https://doi.org/10.1016/j.aquatox.2022.106227
14. Lemen D., Rokita S.E. Polar Interactions between Substrate and Flavin Control Iodotyrosine Deiodinase Function. Biochemistry. 2024;63(18):2380-2389. https://doi.org/10.1021/acs.biochem.4c00357
15. Nappi A., Murolo M., Cicatiello A.G. et al. Thyroid Hormone Receptor Isoforms Alpha and Beta Play Convergent Roles in Muscle Physiology and Metabolic Regulation. Metabolites. 2022;12(5):405. https://doi.org/10.3390/metabo12050405
16. Kim Y.A., Kim Y.A., Cho S.W. et al. Increased expression of thyroid hormone receptor alpha and estrogen receptor alpha in breast cancer associated with thyroid cancer. European Journal of Surgical Oncology. 2021;47(6):1316-1323. https://doi.org/10.1016/j.ejso.2021.01.015
17. Kong D., Li J., Li N. et al. Multiple bioanalytical methods reveal a thyroid-disrupting mechanism related to the membrane receptor integrin αvβ3. Environmental Pollution. 2021;279:116933. https://doi.org/10.1016/j.envpol.2021.116933
18. Hein D.W., Millner L.M. Arylamine N-acetyltransferase acetylation polymorphisms: paradigm for pharmacogenomic-guided therapy- a focused review. Expert Opinion on Drug Metabolism & Toxicology. 2021;17(1):9–21. https://doi.org/10.1080/17425255.2021.1840551
19. Su Z., Zhang Y., Tang J. et al. Multifunctional acyltransferase HBO1: a key regulatory factor for cellular functions. Cellular & Molecular Biology Letters. 2024;29(1):141. https://doi.org/10.1186/s11658-024-00661-y
20. Katarzyńska-Banasik D., Kowalik-Chanek K., Kozubek A. et al. Expression profile of thyroid hormone deiodinases in the adult laying hen (Gallus gallus domesticus). Poult Sci. 2025;104(12):106079. https://doi.org/10.1016/j.psj.2025.106079
21. Katarzyńska-Banasik D., Kowalik K., Sechman A. Influence of silver nanoparticles on mRNA expression of thyroid hormone-related genes in the thyroid gland and liver of laying hens. Domest Anim Endocrinol. 2024;86:106820. https://doi.org/10.1016/j.domaniend.2023.106820
22. Przybył B.J., Szlis M., Misztal A. et al. QRFP43 modulates the activity of the hypothalamic-pituitary-thyroid axis in female sheep. Sci Rep. 2025;15(1):1085. https://doi.org/10.1038/s41598-025-85693-w
23. Martinez M.E., Wu Z., Hernandez A. Paternal developmental thyrotoxicosis disrupts neonatal leptin leading to increased adiposity and altered physiology of the melanocortin system. Front Endocrinol (Lausanne). 2023;14:1210414. https://doi.org/10.3389/fendo.2023.1210414
24. Moran C., Chatterjee K. Resistance to thyroid hormone due to defective thyroid receptor alpha. Best Pract Res Clin Endocrinol Metab. 2015;29(4):647-57. https://doi.org/10.1016/j.beem.2015.07.007
25. Sasidharan Pillai S., Quintos J.B. Thyroid function tests of iodine deficiency goiter can mimic thyroid hormone resistance alpha. J Pediatr Endocrinol Metab. 2022;35(11):1433-1436. https://doi.org/10.1515/jpem-2022-0345
26. Pappa T., Refetoff S. Resistance to Thyroid Hormone Beta: A Focused Review. Front Endocrinol (Lausanne). 2021;12:656551. https://doi.org/10.3389/fendo.2021.656551
27. Zheng J., Duan H., Jiang Z. et al. Identification and functionalization of thyrotropin receptor antibodies with different antigenic epitopes. Am J Physiol Endocrinol Metab. 2024;327(3):E328-E343. https://doi.org/10.1152/ajpendo.00123.2024
28. Fagerberg L., Hallström B.M., Oksvold P. et al. Analysis of the human tissue-specific expression by genome-wide integration of TRαnscriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 2014;13(2):397-406. https://doi.org/10.1074/mcp.M113.035600
Об авторах
Елена Алексеевна ИльичеваРоссия
д.м.н., профессор, заведующая научным отделом клинической хирургии ИНЦХТ;
врач-хирург хирургического торакального отделения ИОКБ
Любовь Викторовна Родионова
Россия
к.б.н., заведующая лабораторией клеточной патофизиологии и биохимии
Лилия Григорьевна Самойлова
Россия
младший научный сотрудник лаборатории клеточной патофизиологии и биохимии
Татьяна Аркадьевна Рой
Россия
младший научный сотрудник научного отдела клинической хирургии
Глеб Александрович Берсенев
Россия
к.м.н., ассистент кафедры госпитальной хирургии ИГМУ;
врач-хирург отделения портальной гипертензии ИОКБ
Дополнительные файлы
Рецензия
Для цитирования:
Ильичева Е.А., Родионова Л.В., Самойлова Л.Г., Рой Т.А., Берсенев Г.А. ЭКСПРЕССИЯ ГЕНОВ ЙОДТИРОН-ДЕЙОДИНАЗ 1, 2 И 3 ТИПОВ, ЙОДТИРОЗИН-ДЕЙОДИНАЗЫ, РЕЦЕПТОРА ТИРЕОИДНЫХ ГОРМОНОВ АЛЬФА И БЕТА И АЦЕТИЛТРАНСФЕРАЗ 1 И 2 ТИПА У БОЛЬНЫХ С ЭУТИРЕОИДНЫМ И ТОКСИЧЕСКИМ ЗОБОМ В ИРКУТСКОЙ ОБЛАСТИ. Байкальский медицинский журнал. 2025;4(4).
For citation:
Ilyicheva E., Rodionova L., Samoilova L., Roy T., Bersenev G. EXPRESSION OF GENES OF IODOTHYRONINE DEIODINASES TYPES 1, 2 AND 3, IODOTYROSINE DEIODINASE, THYROID HORMONE RECEPTOR ALPHA AND BETA AND ACETYLTRANSFERASES TYPES 1 AND 2 IN PATIENTS WITH EUTHYROID AND TOXIC GOITER IN THE IRKUTSK REGION. Baikal Medical Journal. 2025;4(4).



















