Перейти к:
РЕДАКТИРОВАНИЕ ГЕНОМА (ЛЕКЦИЯ)
https://doi.org/10.57256/2949-0715-2025-4-1-84-97
Аннотация
Актуальность. Наследственная патология имеет большой удельный вес в заболеваемости человека. Поэтому актуальной проблемой является поиск методов лечения наследственной патологии. В настоящий момент имеются теоретические основы и практические решения для разработки методов этиологического лечения наследственной патологии. В связи с этим методы редактирования генома являются наиболее перспективным подходом в лечении наследственной патологии.
В лекции рассматриваются исторические аспекты развития научной мысли в сфере редактирования генома, технологические системы, протоколы и этапы разработки терапии наследственной патологии с помощью редактирования генома.
Заключение. Редактирование генома – один из наиболее перспективных методов лечения наследственной патологии, поэтому осведомленность врачей в этом вопросе позволит в дальнейшем шире использовать разработки молекулярной биологии для лечения генетических заболеваний человека.
Ключевые слова: редактирование генома, этиологическое лечение наследственной патологии, метод цинковых пальцев, технология TALEN, CRISPR-Cas.
Ключевые слова
Для цитирования:
Ткачук Е.А., Семинский И.Ж. РЕДАКТИРОВАНИЕ ГЕНОМА (ЛЕКЦИЯ). Байкальский медицинский журнал. 2025;4(1):84-97. https://doi.org/10.57256/2949-0715-2025-4-1-84-97
For citation:
Tkachuk E.A., Seminsky I.Zh. GENOME EDITING (LECTURE). Baikal Medical Journal. 2025;4(1):84-97. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-1-84-97
Значение для генетики и медицины
Хорошо известно, что генетический груз человека увеличивается с каждым новым поколением [1]. Некоторые авторы полагают, что здоровыми можно считать только около 10 % современного населения планеты, и большой вклад в патологию вносят именно наследственные заболевания и наследственно обусловленные состояния. Каждый родитель передает своим детям около 30 мутантных генов, а значит, частота наследственной патологии будет и далее увеличиваться, и к ней будет присоединяться патология, вызванная мутациями de novo [2]. В связи с этим лечение наследственной патологии это одна из важнейших задач современной медицины. Однако на сегодняшний момент для лечения наследственной патологии используются только симптоматические и отчасти патогенетические методы коррекции. Наиболее радикальный и эффективный метод лечения - этиологический практически не применяется. Хотя уже разработаны теоретические подходы к этиологическому лечению наследственной патологии. В связи с тем, что причиной наследственной патологии в основном являются мутации в генетическом аппарате клетки, то и основным этиологическим методом лечения наследственной патологии должно стать исправление мутаций в ДНК. Таким методом может стать редактирование генома [3].
Редактирование генома включает: лечение наследственных болезней (позволяет исправлять генетические мутации, вызывающие болезни), создание инновационных методов терапии (при разработке таргетной терапии онкологических заболеваний), изучение заболеваний (генно-модифицированные модели организмов позволяют изучать патогенез заболеваний), персонализированная медицина (способствует созданию индивидуализированных методов лечения на основе генетического профиля пациента) [2].
Таким образом, редактирование генома открывает новые горизонты в лечении и профилактике многих заболеваний.
Определение
Редактирование генома это один из видов генной инженерии, при котором проводится включение, удаление или перемещение фрагментов дезоксирибонуклеиновой кислоты (ДНК) в геноме организма, т.е. модификация генома.
История вопроса
История редактирования генома начиналось со становления генетики как науки, но, пожалуй, самые важные открытия связаны с развитием молекулярной биологии. Понимание механизмов хранения и передачи генетической информации началось с открытия нуклеиновых кислот швейцарским химиком Фридрихом Мишером в 1868 г., который выделил из гноя, содержавшего погибшие клетки вещество нуклеин. Ф.Мишер смог определить, что полученное вещество является кислотой, однако функции "нуклеина" ему были не понятны. Позже термин "нуклеиновые кислоты" ввел немецкий учёный Рихард Альтман в 1889 г., он же выделил их в чистом виде [5].
В 1928 г. английский врач Фредерик Гриффит открыл явление трансформации при работе с пневмококком (трансформация – это направленный перенос и встраивание в генетический аппарат клетки фрагмента чужеродной ДНК, при котором клетка приобретает новые свойства). А в 1944 г. Освальд Эйвери, Колин Мак-Леод и Маклин Мак-Карти, экспериментируя с белками, полисахаридами и нуклеиновыми кислотами (ДНК), доказали, что трансформацию вызывают только ДНК, а белки и полисахариды таким эффектом не обладают, тем самым они определили генетическую роль ДНК [5].
В 1952 г. Альфред Херши и Марта Чейз доказали, что ДНК содержит информацию как о собственном воспроизведении, так и о строении определенного белка. В 1957 г. Хейнцом Френкель-Конратом это положение было дополнено, тем, что генетическую информацию может нести и рибонуклеииновая кислота (РНК) [5].
Фундаментальным событием в молекулярной биологии явилось открытие в 1953 г. Джеймсом Уотсоном и Френсисом Криком структуры ДНК. Открытие состоялось при использовании правила Чаргаффа, на основании рентгеноструктурных данных, полученных Розалиндой Франклин на кристаллографе и Морисом Уилкинсом (ее руководителем, получившим Нобелевскую премию после ее смерти) [5].
На основании структурной модели ДНК Георгий Гамов предположил, что кодоны должны состоять из трёх нуклеотидов, чтобы кодонов хватило для всех 20 аминокислот. А в 1961 году триплетность генетического кода удалось подтвердить экспериментально Маршаллу Ниренбергу и его коллеге Генриху Маттеи. Соответствия между кодонами и аминокислотами были установлены в 1962 г. Северо Очоа [5].
Дальнейшие исследования позволили создать научную базу для современной технологии редактирования генома. Так в 1967 г. Артуром Корнбергом был проведен синтез in vitro биологически активной ДНК; в 1970 г. Гобиндом Кораном химическим способом синтезирован ген; в 1970 г. открыта обратная транскриптаза (Говард Темин, Дэвид Балтимор, Ренато Дульбеко); в 1972 г. Пол Эберли смог изолировать и вставить фрагменты ДНК, что стало основой для будущего редактирования генов. В 1972 году в лаборатории Пола Берга ученые объединили геном кишечной палочки с генами бактериофага и вируса SV40, что способствовало возникновению технологии получения рекомбинантной ДНК и зарождению генетической инженерии. Дальнейшие успехи науки сопровождались важнейшими для генной инженерии открытиями. Так в 1973 г. Фредериком Сэнгером создан аналитический метод установления последовательности в ДНК; в 1974 г. открыты рестриктазы (Гамильтон Смит, Даниэль Натанс, Вернер Арбер); в 1987 г. Кери Муллисом создан метод полимеразной цепной реакции (ПЦР); в 1990 г. прошла первая успешная терапия геномной замены у человека для лечения наследственного заболевания. Впервые группой японских учёных под руководством Ёсидзуми Исино в 1987 году у Escherichia coli был обнаружен локус CRISPR. Но они не придали своему открытию большого значения. В дальнейшем изучение CRISPR продолжил испанский исследователь Франсиско Мохика. В 1993 г. он обнаружил повторяющиеся последовательности, разделённые промежутками, в геноме археи Haloferax mediterranei. В 2002 г. были открыты гены cas – гены локусов CRISPR, кодирующие белки Cas. В 2007 г. Филиппом Хорватом была установлена и доказана роль CRISPR как основы адаптивного иммунитета бактерий. В 2012 г. Дженнифер Дудна и Эммануэль Шарпантье опубликовали работу, в которой описали, как использовать CRISPR для точного редактирования генома. За эту работу в 2020 году они получили Нобелевскую премию по химии. А в 2017 г. прошли первые клинические испытания лечения серповидно-клеточной анемии с использованием CRISPR [5].
Технологии
Редактирование — это изменение первичной структуры транскриптов после их синтеза, т. е. изменение генетической информации на уровне РНК.
Одной из первых технологий редактирования генома, которая до сих пор остается актуальной, явилось применение программируемых искусственных нуклеаз [6] (направленная геномная инженерия с применением программируемых искусственных нуклеаз (НГИПИН)) [5].
Цель редактирования генома – это внесение заранее известных изменений в его структуру. И если синтез искусственных генов был открыт еще в 1970 году (Гобинд Корана), то на пути к успешному их внедрению в геном вставал вопрос о точности доставки изменений (новых генов) в конкретный участок молекулы ДНК. Встраивание экзогенного материала в ДНК происходит на основании гомологичной рекомбинации между эндогенным локусом-мишенью и введенным экзогенным фрагментом ДНК. Такая возможность впервые была показана на клетках дрожжей [5]. В 80-х годах метод был адаптирован для клеток млекопитающих [2, 3], и до сегодняшнего дня он используется при конструировании перевиваемых клеточных линий или для получения “нокаутных” животных [4]. Однако у данной технологии было серьезное ограничение. Частота естественных рекомбинаций ДНК оказалась мала, что делало данный метод малоприменимым на практике. К тому же случайное встраивание необходимых нуклеотидных последовательностей в геном было низко эффективно, так как ген может попасть в мало экспрессируемый участок, на него могут повлиять окружающие гены и изменить его функциональные свойства, а это может вызвать неблагоприятные и неожиданные последствия. Перед исследователями вставал вопрос о внесении точных изменений в геном [5].
В первых экспериментах с редактированием генома были использованы мегануклеазы, которые позволяли внести двухцепочечный разрыв в ДНК и увеличить вероятность встраивания экзогенного материала в геном, но не позволяли сделать это в точно определенном участке ДНК [5, 6].
Мегануклеазы
Мегануклеазы – искусственные аналоги природных нуклеаз, найденных у некоторых прокариот и водорослей (рис. 1). Они используются для расщепления строго определённых и заранее заданных последовательностей ДНК и могут распознавать участок ДНК длинной от 12 до 40 п.н., поэтому мегануклеазы считаются наиболее специфичными естественными рестрикционными ферментами [8].
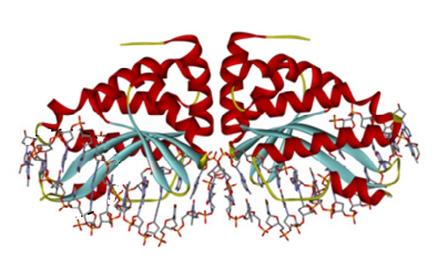
Рис. 1. Мегануклеаза [9]
Цинковые пальцы (ZFN или Zinс Finger Nuclease)
Искусственные нуклеазы с ДНК-специфичным доменом класса «цинковые пальцы» (Zinс Finger Nuclease, или ZFN) – это искусственная ДНК рестриктаза. Название «Цинковые пальцы» нуклеаза получила из-за наличия в своей структуре специфического домена, содержащего 2 цистеиновых и 1 гистидиновый остаток (рис. 2). Свойства этих аминокислот позволяет взаимодействовать с ионом цинка (Zn), образуя стабильную структуру. В итоге Zn соединяет цистеин и гистидин, а полипептидная цепочка, расположенная между ними, образует петлю, напоминающую палец. В естественной среде «цинковые пальцы» играют важную роль в регуляции экспрессии генов. Они связываются с определёнными участками ДНК и регулируют транскрипцию генов. Каждый «цинковый палец» способен «узнать» и специфично связаться с определенной последовательностью ДНК из трех нуклеотидов. Помимо цинкового домена нуклеаза имеет каталитический домен фермента рестрикции. Он называется FokI, состоит из двух субъединиц и выполняет функцию «ножниц» для ДНК. Таким образом ZFN, с одной стороны, может присоединяться к строго определенному месту в ДНК, а присоединившись разрезать ее по месту присоединения [5, 10].
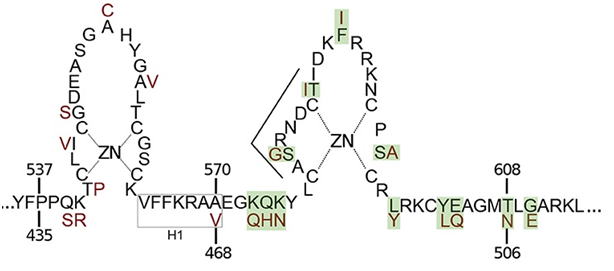
Рис. 2. Схематическое строение нуклеазы типа «цинковых пальцев» [10]
На данный момент ZFN используют в генной терапии в эксперименте на коррекции гемофилии у мышей [11], а также проходят клинические исследования ZFN для нокаута гена ССR5 в лейкоцитах больных СПИДом [12].
ZFN способна точечно воздействовать на заданные участки в составе больших сложных геномов (рис.3), но все же имеет свои недостатки. ZFN не вполне строго распознает тринуклеотидные повторы в ДНК, а значит может разрезать ДНК не всегда в нужном месте, к тому же для каждой последовательности ДНК необходимо создавать свою белковую структуру zinc-finger нуклеазы, а это долго и дорого. Поэтому исследователи не остановились на создании ZFN. [12]
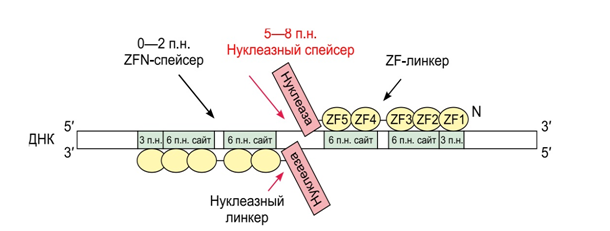
Схематическое изображение стандартной архитектуры ZFN [5]
TALEN (Transcription Activator-Like Effector Nucleases)
Эта технология использует специфические нуклеазы, которые распознают и связываются с определенными последовательностями ДНК. Они могут создавать разрывы в двухцепочечной ДНК и обеспечивать мишенирование для последующего редактирования (рис. 4).
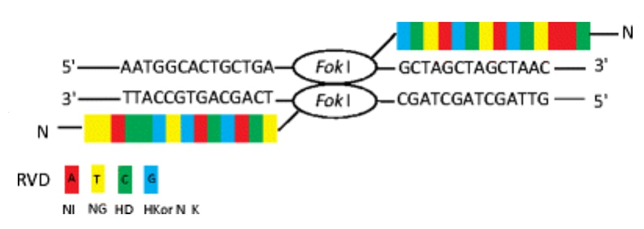
Рис. 4. TALEN-нуклеаза в комплексе с целевой ДНК [13]
Технология TALE была открыта при изучении механизмов восприимчивости и резистентности некоторых растений к бактериям рода Xanthomonas [14, 15]. Белки TALE способны связывать определенные последовательности нуклеотидов. Попадая в ядро растительной клетки, они имитируют транскрипционные факторы и связываются с определенными участками ДНК, активируя таким образом гены, необходимые для выживания паразита (бактерии рода Xanthomonas). Соединяя домен TALE с ферментом, расщепляющим ДНК (FokI), можно получить систему с высокой специфичностью действия [13].
Белки TALE состоят из центрального домена, ответственного за связывание ДНК, сигнала ядерной локализации и домена, активирующего транскрипцию целевого гена [5, 10]. ДНК-связывающий домен TALE состоит из мономеров, каждый из которых связывается с одним нуклеотидом в целевой нуклеотидной последовательности. Мономеры представляют собой тандемные повторы из 34 аминокислот. Два таких мономера (в положении 12 и 13) высоко вариабельны (Repeat Variable Diresidue, RVD). Они отвечают за узнавание определенного нуклеотида. Последний тандемный повтор, связывающий нуклеотид на 3'-конце сайта узнавания, состоит из 20 аминокислотных остатков, поэтому он назван полуповтором. Код узнавания мономеров вариабельных повторов является вырожденным, поэтому некоторые RVD могут связываться с несколькими нуклеотидами с разной эффективностью. Первый аминокислотный остаток в RVD не участвует непосредственно в связывании нуклеотида, а отвечает за стабилизацию пространственной конформации. Второй аминокислотный остаток соединяется с нуклеотидом. Искусственный ДНК-связывающий домен встраивают в генетическую конструкцию, содержащую сигнал ядерной локализации, полуповтор, N-концевой домен и каталитический домен FokI (вместо активатора транскрипции). Для эффективной работы генетической конструкции целевые сайты должны находиться на разных цепях ДНК и быть разделенными небольшим участком, протяженностью 12–25 п.н. (спейсерная последовательность) (рис. 5). При попадании в ядро искусственные нуклеазы связываются с целевыми сайтами, в результате чего расположенные на N-концах химерного белка домены FokI димеризуются и вносят двухцепочечный разрыв в спейсерную последовательность. Теоретически с помощью искусственных нуклеаз типа TALENs двухцепочечный разрыв можно внести в любой участок генома, с известными сайтами узнавания ДНК-связывающих доменов [5].
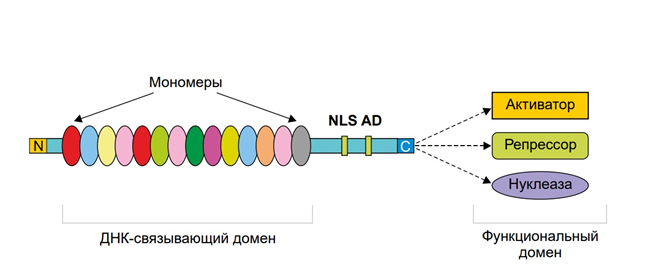
Рис. 5. Общая схема строения TAL с различными вариантами функциональных доменов [5]
Редактирование генома на основе технологии TALEN имеет свои преимущества и недостатки. Так, на ее основе можно сконструировать практически любую последовательность в геноме, уровень трансгенеза выше, а неспецифическая активность значительно ниже, чем у метода ZNF. К тому же процесс создания TALEN нуклеазы занимает значительно меньше времени (всего около 1-2 недель), он менее трудоемкий и значительно дешевле [16]. Недостатком TALEN является большой размер фрагмента RVD, который определяет размер всей TALE-нуклеазы. Это делает невозможным уместить TALEN в некоторые часто используемые вирусные векторы. Другим ограничением программирования TALEN-мишеней является наличие оснований тимина на противоположных цепях, которые могут не соответствовать расстоянию друг от друга при использовании стандартной TALEN-архитектуры. Также длинный ДНК-спейсер между парами TALEN-химер и его большая вариабельность теоретически увеличивает нецелевую активность нуклеазы [16].
CRISPR-Cas9
Одна из самых известных и широко используемых технологий. Она воспроизводит систему природного иммунитета бактерий, позволяющая бактериям избавляться от вирусных вторжений в ДНК. CRISPR- Cas системы были обнаружены в конце 80-ых годов в геноме E. Coli и позднее выявлены у других бактерий (40 %) и архей. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — это кластеризованные регуляторные короткие палиндромные повторы ДНК, разделенные уникальными участками — спейсерами. По сути, CRISPR представляет собой кассету, которая состоит из кластеров (ячеек), их роль выполняют короткие палиндромные повторы, в которых расположены спейсеры. Спейсеры соответствуют участкам из геномов разных вирусов (бактериофагов, плазмид и других мобильных генетических элементов), а набор спейсеров уникален для каждого штамма (рис.6) [17]. По классификации CRISPR/Cas системы разделяют на два класса. В системах класса 1 эффекторный комплекс образован множеством субъединиц, в том числе несколькими белками Cas, а в системах класса 2 эффектором является один большой многодоменный белок. Классы систем CRISPR/Cas подразделяются на несколько типов. К классу 1 относятся типы I, III и IV, а к классу 2 — типы II, V и VI. Деление на типы основано на устройстве эффекторных комплексов, причем в системах одного и того же типа, как правило, в состав комплекса входит особый сигнатурный белок, уникальный для систем этого типа. Типы, в свою очередь, делятся на подтипы, различающиеся особенностями строения локуса CRISPR и, в некоторых случаях, наличием уникальных белков Cas (рис. 6) [ 17].
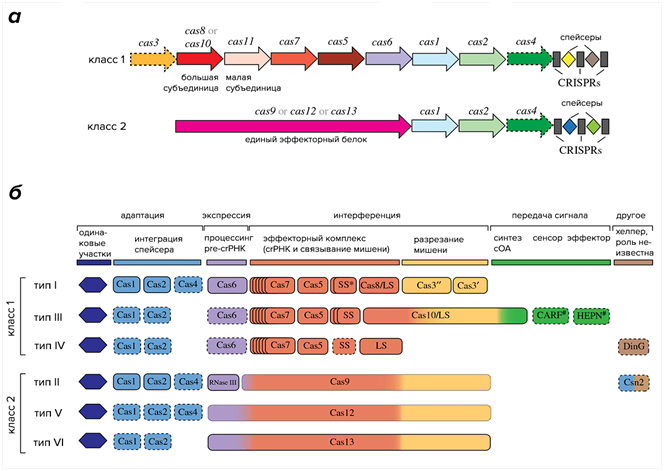
Рис.6. Классификации систем CRISPR-Cas.
(a) Общая организация локусов CRISPR класса 1 и 2. Два класса различаются либо по мультиэффекторному комплексу, либо по одному эффекторному белку.
(б) Каждый класс далее делится на шесть типов на основе генетической, структурной и функциональной организации: класс 1 включает типы I, III и IV, а класс 2 включает типы II, V и VI [17].
Благодаря спейсерам бактерия узнает вирусные последовательности, и таким образом CRISPR-система осуществляет функцию адаптивного иммунитета прокариот (рис. 6) [18, 19].
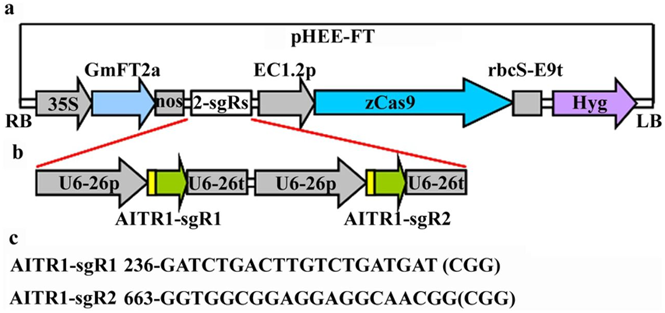
Рис. 7. Генерация кассеты CRISPR/Cas9.
(a) Вектор pHEE с кассетой экспрессии FT.
(b) Кассеты экспрессии sgRNA в конструкции pHEE-FT-AITR1.
(c) Целевые последовательности в гене AITR1 [20]
В отличие от платформ редактирования типа ZNF и TALEN, у которых узнавание целевых участков ДНК происходит за счет белков, в системе CRISPR это происходит за счет нуклеотидных последовательностей (т.е. РНК). Поэтому CRISPR/Cas системы еще называют РНК-направляемые нуклеазы. На сегодняшний момент известно три типа CRISPR/Cas систем (по осуществлению таргетинга): 1) таргетинг осуществляется за счет crRNA-tracrRNA дуплекса; 2) за счет crRNA – CRISPR RNA; 3) за счет tracrRNA – Trans-activating crRNA [5].
Cas называются гены, ассоциированные (фланкирующие) с CRISPR-системой (CRISPR Associated). Именно кодируемые ими белки Cas способны вносить точечные разрывы в молекулу ДНК (т.е. обладают нуклеазной и геликазной активностью) [19].
Гены Cas в системе CRISPR/Cas различают по типам и подтипам. Все они были найдены у разных представителей бактерий и архей [20,21,22] Наиболее известные белки Cas9 и Cas12 больше похожи на кодируемый транспозонами белок TnpB [22,23], т.е. содержат эндонуклеазный каталитический сайт RuvC.
Редактирование генома с помощью Cas9 интерферирующей sgRNA заключается в индуцировании двухцепочечного разрыва в определенном месте ДНК, детерминированном последовательностью спейсера sgRNA. Живая клетка в этом месте восстанавливается путем репарации негомологичных концов (NHEJ) или по механизму гомологической рекомбинации (HR). Механизм NHEJ преобладает в клетках млекопитающих и часто приводит к возникновению мутаций рядом с местом разрыва. Этот механизм используют для инактивации какого-либо «вредоносного» гена. Если же необходимо «исправить» последовательность гена, после получения разрыва в ДНК необходимо внести молекулу ДНК с «правильной» последовательностью и фланкирующими участками, соответствующими последовательностям ДНК, окружающим сайт разрыва. Такая ДНК служит матрицей для репарации по механизму HR [24,25].
Существует еще целый ряд менее известных технологий редактирования генома, таких как Prime Editing, Base Editing, CRISPR/Cas12 и CRISPR/Cas13. Prime Editing эта относительно новая технология, которая позволяет вносить более точные изменения в геном и заменять отдельные основания без создания двойных разрывов ДНК, что снижает количество неопределенных мутаций. Технология Base Editing - метод, который позволяет заменять отдельные нуклеотиды с высокой точностью без создания разрывов ДНК. Метод основывается на использовании модифицированных нуклеаз и механизма репарации клеток. Технология CRISPR/Cas12 и CRISPR/Cas13 - эти системы являются более усовершенствованными версиями CRISPR и используются для редактирования РНК (Cas13) или имеют другие механизмы активации и высокой специфичности (Cas12) [26,27].
Каждая из этих технологий имеет свои преимущества и недостатки, и выбор метода зависит от конкретных целей, требований к точности и доступных ресурсов [28].
Приборная база
Несмотря на сложность самого процесса редактирования генома, приборная база, которая для этого используется достаточна проста. Она включает [29]:
- ПЦР-термоклиматоры (ПЦР-контроллеры). Они используются для амплификации специфических фрагментов ДНК, анализа и подготовки образцов для редактирования.
- Электрофорез, который используется для проверки успешности редактирования или амплификации ДНК, в процессе аппаратного разделения молекул ДНК, РНК или белков в геле на основе их размера и заряда.
- Секвенаторы используют для подтверждения изменения и анализа вновь полученных геномных последовательностей.
- Цифровые микроскопы используют для оценки морфологии клеток и их состояния после редактирования генов.
- Системы для трансфекции - устройства для введения редактируемых молекул (CRISPR-Cas9 или TALEN) в клетки химиотерапевтическим путем или при помощи электропорации.
- Системы для хранения образцов. Лабораторные морозильники и криогенные установки для хранения клеток и образцов при низких температурах.
- Инкубаторы для клеточных культур, которые поддерживают необходимые условия для роста клеток in vitro после редактирования.
- Автоматизированные системы для клеточных манипуляций - роботизированные платформы для автоматизации процессов манипуляций с клетками, включая их перемещение, подачу реагентов и лекарственных препаратов.
- Программное обеспечение для анализа данных при секвенировании, редактировании генов и прогнозировании его результатов.
Эти инструменты играют важную роль в проведении успешных экспериментов по редактированию генома и обеспечивают высокую точность и надежность процессов [29].
Протоколы
Протоколы редактирования генома могут варьироваться в зависимости от используемой технологии (например, CRISPR, TALEN, ZFN) и типа клеток или организмов, с которыми работает исследователь. Однако общие этапы редактирования генома, следующие [30]:
- Проектирование и синтез.
1.1. Выбор целевого гена (определение целевой последовательности ДНК, которую необходимо редактировать).
1.2. Создание направляющих молекул (для CRISPR: разработка специфичной одноцепочечной РНК (sgRNA); для TALEN или ZFN: проектирование специфичных нуклеаз).
1.3. Синтез молекул (закупка или синтез sgRNA, нуклеаз и других необходимых реагентов).
- Трансфекция
2.1. Подготовка клеток (культивирование клеток или установление систем организма (например, эмбрионов, растений) для редактирования).
2.2. Введение редакционного инструмента (применение методов трансфекции (химические, электропорация, вирусные векторы) для введения редактирующих молекул в клетки).
2.3. Инкубация (обеспечение адекватных условий (температура, CO2, культура) для экспрессии редакционного инструмента).
- Выращивание и отбор
3.1. Отбор редактированных клеток (использование антибиотиков или других селективных агентов для формирования популяций клеток с редактированным геном).
3.2. Клонирование (отбор отдельных клеток и клонирование для получения однородной популяции редактированных клеток).
- Анализ
4.1. Проверка редактирования (применение ПЦР, секвенирования или других методов для подтверждения внесенных изменений в геном).
4.2. Проверка на внецелевые мутации (анализ возможности непредвиденных изменений в геноме, которые могли произойти в процессе редактирования).
- Фенотипическая оценка
5.1. Изучение фенотипов (оценка изменений в клетках или организмах после редактирования (например, влияние на экспрессию генов, морфологию и функциональность)).
5.2. Долгосрочные наблюдения (наблюдение за стабильностью редактированных характеристик в течение времени).
- Документация и анализ данных
6.1. Запись данных (подробная запись всех этапов, экспериментальных условий и результатов).
6.2. Анализ результатов (статистическая обработка и анализ полученных данных).
Эти протоколы могут быть адаптированы в зависимости от конкретных целей исследования, типа клеток, используемой технологии и желаемых результатов. Всегда рекомендуется использовать проверки безопасности и соответствие этическим стандартам при редактировании генома [30].
Методы доставки редактированных генов в клетки
Для получения непосредственного практического эффекта от редактирования генома нужен еще один этап, позволяющий донести полученный генетический материал до живой клетки. Методы доставки генетического материала помимо роли в редактировании генома играют самостоятельную роль как метод генной терапии. Эти методы служат также основой для модулирования экспрессии собственных генов или внесения нормально функционирующих копий генов взамен дефектных. Существует несколько вариантов внесения генетического материала в клетку (рис. 8) [19].
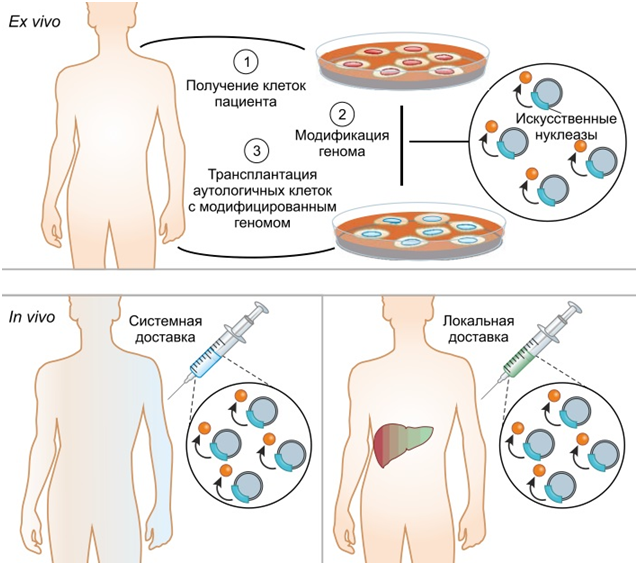
Рис. 8. Схематическое изображение двух концепций терапии наследственных заболеваний: редактирование геномов ex vivo и in vivo [19].
Химические
Применение липидных векторов в виде липосомы на сегодняшний день является наиболее используемым способом доставки нуклеиновых кислот. Также эффективно используются твердые липидные наночастицы, полимерные векторы для доставки ДНК in vivo.
Физические
Физические методы доставки генетического материала основаны на повреждении плазматической мембраны, приводящее к проникновению чужеродного генетического материала в цитозоль [19]. Такие методы используются для трансформации культур клеток.
Наиболее распространенный метод электропорации это классический физический метод переноса генов, основанный на формировании с помощью электрического тока пор, что позволяет молекулам ДНК диффундировать внутрь клеток, однако при этом большинство клеток гибнет. Более щадящей техникой является сонопорация – обработка ткани-мишени ультразвуком. Для доставки генетического материала в клетки методом сонопорации ДНК иммобилизуют на поверхности микропузырьков и вводят в кровоток с последующим приложением ультразвука в проекции органа-мишени. Сонопорацию используют для доставки генетического материала в мозг, почки, брюшную полость, а также в мышечную ткань, включая сердечную мускулатуру, и др. [31]. В редких случаях для доставки генетического материала in vivo используют гидропорацию – повышение проницаемости мембраны за счет резкого изменения гидродинамического давления. Давление создается инъекцией больших объемов растворов ДНК в короткий промежуток времени. Такое воздействие увеличивает проницаемость эндотелия капилляров и формирует поры в плазматической мембране окружающих клеток паренхимы, через которые проникает ДНК. Этот метод, как правило, используется для генной терапии клеток печени [31].
Вирусные
Для доставки генетического материала часто применяют вирусные векторы. При этом методе используется естественная способность вируса вносить свой генетический материал не просто внутрь клетки, а внедрять его в ядерную ДНК хозяина. В зависимости от задач используют аденовирусы, лентовирусы, ретровирусы, вирусы герпеса и др. Вирусные векторы состоят из генетического материала, окруженного белковым капсидом или липидной оболочкой вируса, которые взаимодействуют со специфическими рецепторами на поверхности клеток, обеспечивая внедрение генетической конструкции в клетки-мишени [30]. Получают вирусные векторы из нативных вирусных частиц путем замены собственных генов вируса на генноинженерные конструкции. Преимущество вирусных векторов в их использовании в живом организме (in vivo), в который можно ввести вирусную генноинжинерную конструкцию и путем трансфекции произойдет внедрение искусственного генного материала в клетки реципиента. Также вирусные векторы лучше, по сравнению с невирусными, справляются с задачей долговременной экспрессии целевых генов в клетках-мишенях [29].
В настоящий момент создан широкий спектр рекомбинантных аденоассоциированных вирусных векторов (ААВ), способных доставлять генетический материал в ткани-мишени с минимальными побочными эффектами. ААВ обеспечивает длительную экспрессию трансгена, особенно в неделящихся клетках, и поэтому после однократной инъекции ААВ-препарата экспрессия трансгена может наблюдаться длительное время.
Ретровирусные векторы вызывают большой интерес как платформа для создания новых вирусных векторов, однако их эффективность ограничивается низкой трансдукцией неделящихся клеток. Поэтому использование гамма-ретровирусных векторов ограничивается их применением при переносе генов в гемопоэтические клетки [20].
Лентивирусные векторы, напротив, способны трансдуцировать неделящиеся и медленно делящиеся клетки, что существенно расширяет возможности их использования для доставки генетического материала в различные ткани и органы, в том числе в центральную нервную систему [21]. Однако необходимо учитывать их способность к интеграции в геном клетки-хозяина, которое происходит случайным образом и может запускать инсерционный онкогенез [31].
Большим потенциалом для использования в клинике обладают герпесвирусные векторы, полученные на основе вируса простого герпеса 1 типа (ВПГ-1), так как они обладают выраженным тропизмом к нейронам, а вирусные частицы даже могут перемещаться транссинаптически от нейрона к нейрону и персистировать в нейронах, несмотря на иммунную защиту. Однако относительно высокая цитотоксичность ВПГ-векторов пока ограничивает их применение в практике [32].
В настоящий момент существует более 40 генотерапевтических препаратов, которые либо хорошо себя зарекомендовали в лечении наследственной патологии, либо проходят клинические испытания (см. табл. 1) [2, 33]. Перечень препаратов пополняется ежегодно и на сегодня известны препараты для генной терапии сердечной недостаточности, ишемической болезни сердца, глиобластомы, мезотелиомы, гепатоцеллюлярной карциномы, критической ишемии нижних конечностей, рефрактерной анапластической крупноклеточной лимфомы, глиомы, синдрома диабетической стопы, нейропатии, остеоартрита у пожилых людей, хронического грануломатоза (сцепленного с Х-хромосомой), синдрома Вискотта - Олдрича [34].
Таблица 1. Некоторые препараты для генной терапии [2,33,34]
Заболевания | Препарат | Ген | Молекулярно-генетический подход к терапии | Способ введения/частота применения |
Спинально-мышечная атрофия | Спинраза (Spinraza) / Нусинерсен (Nusinersen)
| SMN2 | Антисмысловой олигонуклеотид,
| Интратекальная В течение первого года 6 раз,
|
Спинально-мышечная атрофия | Золгенсма (Zolgensma)
| SMN1 | Правильная копия гена SMN1, доставленная аденоассоциированным вирусным вектором
| Внутривенная инфузия. Однократно
|
Мышечная дистрофия Дюшенна | Казимерсен (Amondys 45) | DMD (мутация экзона 45) | Фосфородиамидатный антисмысловой морфолиновый олигонуклеотид , терапевтический эффект достигается пропуском экзона 45 | Внутривенная инфузия |
Мышечная дистрофия Дюшенна | Этеплирсен (Exondys 51) | DMD (мутация экзона 51) | Антисмысловой олигонуклеотид, терапевтический эффект достигается пропуском экзона 51 | Внутривенная инфузия |
Миодистрофия Дюшенна
| Эксондис 51 (Exondys 51) /Этеплирсен (Eteplirsen)
| DMD (мутация экзона 51) | Антисмысловой олигонуклеотид, который связывается с незрелой мРНК гена DMD, для пропуска экзона 51 из мРНК
| Внутривенная инфузия. Еженедельно
|
Миодистрофия Дюшенна
| Голодирсен (Vyondys 53)/ Вилтоларсен (Viltepso) | DMD (мутация экзона 53) | Нацелен на пропуск экзона 53 | Внутривенная инфузия |
Cиндром семейной хиломикронемии
| Воланесорсен (Waylivra) | LPL | Антисмысловой олигонуклеотид | Внутривенная инфузия |
Семейная гиперхолестеринемия
| Мипомерсен (Kynamro) | LDLR | антисмысловой олигонуклеотид, действующий как ингибитор синтеза аполипопротеина В-100
| Внутривенная инфузия |
Cемейный дефицит липопротеинлипазы
| Алипоген типарвовек (Glybera) | LPL | Векторный транспорт генетического материала в клетку | Внутривенная инфузия |
Бета-талассемия
| Бетибеглоген аутотемцел(Zynteglo) | HBB | Векторный транспорт функциональной последовательности модифицированного гена βA-глобина (βA-T87Q-глобина) | Внутривенная инфузия |
Серповидно-клеточная анемия
| Ловотибеглоген аутотемцел (Lyfgenia) | HBB | Векторный транспорт функциональной копии βA-T87Q-глобина | Внутривенная инфузия |
Адренолейкодистрофия у детей
| Эливалдоген аутотемцел(Skysona) | ABCD1 | Векторный транспорт функциональной копии ABCD1 | Внутривенная инфузия |
Гемофилия А | Валоктокоген роксапарвовек (Roctavian) | F8 | Векторный транспорт функциональной копии гена фактора VIII | Внутривенная инфузия |
Гемофилия B
| Этранакоген дезапарвовек (Hemgenix) | F8 | Векторный транспорт функциональной копии вариантв Padua гена фактора IX | Внутривенная инфузия |
Дистрофии сетчатки | Лукстурна (Luxturna)
| RPE65 | Векторный транспорт функциональной копии RPE65
| Субретинальная инъекция. Однократно
|
Наследственный транстиретин опосредованный амилоидоз
| Онпаттро (Onpattro)/ Патисиран
| TTR | Двуцепочечные малые интерферирующие РНК (миРНК), которые приводят к деградации транстиретина
| Внутривенная инфузия. Каждые 3 недели
|
Наследственный транстиретин- опосредованный амилоидоз
| Тегседи (Tegsedi)/ Инотерсен (Inotersen)
| TTR | Двуцепочечные малые интерферирующие РНК (миРНК), которые приводят к деградации транстиретина
| Подкожная инъекция. Еженедельно
|
Заключение
Редактирование генов представляет огромные возможности в различных областях науки и медицины. Редактирование генома используют в медицине, сельском хозяйстве, молекулярной биологии, биоинженерии.
Наиболее перспективным применением редактирования генома в медицине является генотерапия как метод лечения наследственных заболеваний путем исправления дефектных генов; в онкологии для удаления или модификации онкогенов; в разработке вакцин и иммунной терапии; в клеточной терапии [35].
Однако методы редактирования генома вызывают ряд не только технических, но и этических вопросов, связанных с безопасностью и последствиями для организма и экосистемы в целом. Общественное обсуждение и регулирование этих технологий являются важными аспектами их применения [36]. Поэтому, признание потенциальных проблем безопасности, связанных с редактированием генов, подчеркивает важность мониторинга пациентов во время и после лечения. Однако недавние исследования по редактированию РНК дают дополнительные надежды на целевые терапевтические молекулярные подходы к модификации клеточных белков без потенциальных проблем безопасности, связанных с редактированием генов ДНК [18].
Список литературы
1. Боринская С.А., Янковский Н.К. Генетика и геномика человека. популяции и этносы в пространстве и времени: эволюционные и медицинские аспекты. Вавиловский журнал генетики и селекции. 2013;17(4/2): 930-942 [Borinskaya S.A., Yankovsky N.K. Human genetics and genomics. Populations and ethnic groups in space and time: evolutionary and medical aspects. Vavilov Journal of Genetics and Breeding. 2013;17(4/2): 930-942 (In Russian)]. URL: https://vavilov.elpub.ru/jour/article/view/213/215 [дата доступа: 08.02.2025]
2. Гинтер Е.К., Пузырев В.П., Куцев С.И. Медицинская генетика: национальное руководство. Москва: ГОЭТАР-Медиа; 2022: 896 [Ginter E.K., Puzyrev V.P., Kutsev S.I. Medical genetics: national guidelines. M.: GOETAR-Media; 2022: 896 (In Russian)]. doi: 10.33029/9704-6307-9-GEN-2022-1-896
3. Ребриков Д.В. Редактирование генома человека. Вестник РГМУ. 2016;(3):4-15 [Rebrikov D.V. Human genome editing. Bulletin of RSMU. 2016;(3):4-15]. doi: 10.24075/brsmu.2016-03-01.
4. Бочков Н.П., Пузырев В.П., Смирнихина С.А Клиническая генетика: учебник. М.: ГЭОТАР-Медиа; 2022: 592 [Bochkov N.P., Puzyrev V.P., Smirnikhina S.A. Clinical genetics: textbook. Moscow:GEOTAR-Media; 2022: 592 (In Russian)]
5. Редактирование генов и геномов: Том 1. Ред. Закиян С.М., Медведев С.П., Дементьева Е.В. и др. Новосибирск: Издательство СО РАН; 2018: 369 [Gene and Genome Editing: Volume 1. Ed. Zakian S.M., Medvedev S.P., Dementyeva E.V. et al. Novosibirsk: Publishing House of the Siberian Branch of the Russian Academy of Sciences; 2018: 369 (In Russian)]
6. Perez-Pinera P., Kocak D.D., Vockley C.M. et al. RNA-guided gene activation by CRISPR-Cas9-based transcription factors. Nat Methods. 2013; 10(10):973-6. doi: 10.1038/nmeth.2600.
7. Andersen J.B., Thorgeirsson S.S. A perspective on molecular therapy in cholangiocarcinoma: present status and future directions. Hepat Oncol. 2014;1(1):143-157. doi:10.2217/hep.13.4.
8. Chen R., Shi X., Yao X. et al. Specific multivalent molecules boost CRISPR-mediated transcriptional activation. Nat Commun. 2024;15(1):7222. doi:10.1038/s41467-024-51694-y.
9. Silva G., Poirot L., Galetto R. et al. Meganucleases and other tools for targeted genome engineering: perspectives and challenges for gene therapy. Curr Gene Ther. 2011;11(1):11-27. doi:10.2174/156652311794520111.
10. Bagherpoor Helabad M., Volkenandt S., Imhof P. Molecular Dynamics Simulations of a Chimeric Androgen Receptor Protein (SPARKI) Confirm the Importance of the Dimerization Domain on DNA Binding Specificity. Front Mol Biosci. 2020;7:4. doi:10.3389/fmolb.2020.00004
11. Li H., Haurigot V., Doyon Y. et al. In vivo genome editing restores haemostasis in a mouse model of haemophilia. Nature. 2011; 475(7355):217-221. doi: 10.1038/nature10177.
12. Tebas P., Stein D., Tang W.W. et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. N Engl J Med. 2014; 370(10):901-910. doi: 10.1056/NEJMoa1300662.
13. Wang S., Chen H., Tang X. et al. Molecular tools for gene manipulation in filamentous fungi. Appl Microbiol Biotechnol. 2017;101(22):8063-8075. doi:10.1007/s00253-017-8486-z.
14. Van den Ackerveken G., Marois E., Bonas U. Recognition of the bacterial avirulence protein AvrBs3 occurs inside the host plant cell. Cell. 1996;87(7):1307-1316. doi:10.1016/s0092-8674(00)81825-5.
15. Canteros B., Minsavage G., Bonas U., Pring D., Stall R. A gene from Xanthomonas campestris pv. vesicatoria that determines avirulence in tomato is related to avrBs3. Mol Plant Microbe Interact. 199;4(6):628-32. doi: 10.1094/mpmi-4-628
16. Maeder M.L., Angstman J.F., Richardson M.E. et al. Targeted DNA demethylation and activation of endogenous genes using programmable TALE-TET1 fusion proteins. Nat Biotechnol. 2013;31(12):1137-1142. doi:10.1038/nbt.2726
17. Koonin E.V., Makarova K.S. Origins and evolution of CRISPR-Cas systems. Philos Trans R Soc Lond B Biol Sci. 2019;374(1772):20180087. doi:10.1098/rstb.2018.0087
18. Parums D.V. Editorial: First Regulatory Approvals for CRISPR-Cas9 Therapeutic Gene Editing for Sickle Cell Disease and Transfusion-Dependent β-Thalassemia. Med Sci Monit. 2024;30:e944204. doi:10.12659/MSM.944204.
19. Yin H., Song C.Q., Dorkin J.R. et al. Therapeutic genome editing by combined viral and non-viral delivery of CRISPR system components in vivo. Nat Biotechnol. 2016;34(3):328-333. doi:10.1038/nbt.3471
20. Jansen R, Embden JD, Gaastra W, Schouls LM. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol. 2002;43(6):1565-1575. doi:10.1046/j.1365-2958.2002.02839.x.
21. Makarova K.S., Wolf Y.I., Alkhnbashi O.S. et al. An updated evolutionary classification of CRISPR-Cas systems. Nat Rev Microbiol. 2015;13(11):722-36. doi: 10.1038/nrmicro3569
22. Yang P., Chou S.-J., Li J. et al. Supramolecular nanosubstrate-mediated delivery system enables CRISPR-Cas9 knockin of hemoglobin beta gene for hemoglobinopathies. Sci Adv. 2020;6(43):eabb7107. doi: 10.1126/sciadv.abb7107.
23. Alinejad T., Modarressi S., Sadri Z., Hao Z., Chen C.S. Diagnostic applications and therapeutic option of Cascade CRISPR/Cas in the modulation of miRNA in diverse cancers: promises and obstacles. J Cancer Res Clin Oncol. 2023;149(12):9557-9575. doi: 10.1007/s00432-023-04747-6.
24. Koonin E.V., Makarova K.S., Zhang F. Diversity, classification and evolution of CRISPR-Cas systems. Curr Opin Microbiol. 2017;37:67-78. doi: 10.1016/j.mib.2017.05.008.
25. Kanbar K., El Darzi R., Jaalouk D.E. Precision oncology revolution: CRISPR-Cas9 and PROTAC technologies unleashed. Front Genet. 2024;15:1434002. doi: 10.3389/fgene.2024.1434002.
26. Savić N., Schwank G. Advances in therapeutic CRISPR/Cas9 genome editing. Transl Res. 2016;168:15-21. doi: 10.1016/j.trsl.2015.09.008.
27. Chavez M., Chen X., Finn P.B., Qi L.S. Advances in CRISPR therapeutics. Nat Rev Nephrol. 2023;19(1):9-22. doi: 10.1038/s41581-022-00636-2.
28. Banda A., Impomeni O., Singh A. et al. Precision in Action: The Role of Clustered Regularly Interspaced Short Palindromic Repeats/Cas in Gene Therapies. Vaccines (Basel). 2024;12(6):636. doi: 10.3390/vaccines12060636.
29. Ветчинова А.С., Коновалова Е.В., Лунев Е.А., Иллариошкин С.Н. Технология редактирования генома и возможности ее применения в клеточной нейробиологии. Анналы клинической и экспериментальной неврологии. 2015; 9(4):59-64 [Vetchinova A.S., Konovalova E.V., Lunev E.A., Illarioshkin S.N. A genome editing technology and capabilities of its application in cellular neurobiology. Annals of Clinical and Experimental Neurology. 2015; 9(4):59-64 (In Russian)]. URL: https://cyberleninka.ru/article/n/tehnologiya-redaktirovaniya-genoma-i-vozmozhnosti-ee-primeneniya-v-kletochnoy-neyrobiologii [дата доступа: 08.02.2025]
30. Мензоров А.Г., Лукьянчикова В.А., Кораблев А.Н., Серова И.А., Фишман В.С. Практическое руководство по редактированию геномов системой CRISPR/Cas9. Вавиловский журнал генетики и селекции. 2016;20(6):930944 [Menzorov A.G., Lukyanchikova V.A., Korablev A.N., Serova I.A., Fishman V.S. Genome editing using CRISPR/Cas9 system: a practical guide. Vavilovskii Zhurnal Genetiki i Selektsii =Vavilov Journal of Genetics and Breeding. 2016;20(6):930-944 (In Russian)]. DOI 10.18699/VJ16.214
31. Orlando S.J., Santiago Y., DeKelver R.C. et al. Zinc-finger nuclease-driven targeted integration into mammalian genomes using donors with limited chromosomal homology. Nucleic Acids Res. 2010;38(15):e152. doi:10.1093/nar/gkq512
32. Cheng Y., Zhang N., Hussain S. et al. Integration of a FT expression cassette into CRISPR/Cas9 construct enables fast generation and easy identification of transgene-free mutants in Arabidopsis. PLoS One. 2019;14(9):e0218583. doi:10.1371/journal.pone.0218583
33. Гуревич К.Г., Сорокина Ю.А., Ураков А.Л. и др. Геннотерапевтические препараты: особенности применения в гериатрической и педиатрической практике. Обзоры по клинической фармакологии и лекарственной терапии. 2020; 18(3): 237–244 [Gurevich K.G., Sorokina Yu.A., Urakov A.L. et al. Drugs for gene therapy: features of usage in geriatrics and pediatrics. Reviews on Clinical Pharmacology and Drug Therapy. 2020;18(3):237-244 (In Russian)]. doi: 10.17816/RCF183237-244
34. Галицына Е.В., Куликова Е.А., Павельев Ю.А. и др. Современные генотерапевтические лекарственные препараты. Гены и клетки. 2024;19(1): 21–42 [Galitsyna E.V., Kulikova E.A., Paveliev Yu.A. et al. Modern gene therapy drugs. Genes & Cells. 2024;19(1): 21–42 (In Russian)]. doi: 10.17816/gc601855
35. Ткачук Е.А., Семинский И.Ж. Роль генетики в современной медицине. Байкальский медицинский журнал. 2022;1(1):81-88 [Tkachuk E.A., Seminsky I.Zh. The role of genetics in modern medicine. Baikal Medical Journal. 2022;1(1):81-88 (In Russian)]. doi: 10.57256/2949-0715-2022-1-81-88
36. Пестрикова А.А. Правовые и этические нормы редактирования генома человека. Журнал зарубежного законодательства и сравнительного правоведения. 2021;17(5):37-51 [Pestrikova A.A. Analysis of Legal and Ethical Standards in the Field of Human Gene Editing. Journal of Foreign Legislation and Comparative Law. 2021;17(5):37-51 (In Russian)]. doi: 10.12737/jflcl.2021.052
Об авторах
Елена Анатольевна ТкачукРоссия
д.м.н., доцент, профессор кафедры патологической физиологии и клинической лабораторной диагностики ФГБОУ ВО ИГМУ Минздрава России, Россия, 664003, г. Иркутск, ул. Красного Восстания, 1; старший научный сотрудник ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека», Россия, 664003, г. Иркутск, ул. Тимирязева, 16; ведущий научный сотрудник ФГБНУ «Восточно-Сибирский институт медико-экологических исследований», Россия, 665826, г. Ангарск, микрорайон 12а, дом 3
Игорь Жанович Семинский
Россия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики ФГБОУ ВО ИГМУ Минздрава России,Россия, 664003, г. Иркутск, ул. Красного Восстания, 1
Рецензия
Для цитирования:
Ткачук Е.А., Семинский И.Ж. РЕДАКТИРОВАНИЕ ГЕНОМА (ЛЕКЦИЯ). Байкальский медицинский журнал. 2025;4(1):84-97. https://doi.org/10.57256/2949-0715-2025-4-1-84-97
For citation:
Tkachuk E.A., Seminsky I.Zh. GENOME EDITING (LECTURE). Baikal Medical Journal. 2025;4(1):84-97. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-1-84-97



















