Перейти к:
ТЕЛЕМЕТРИЧЕСКИЙ КОНТРОЛЬ ЭЛЕКТРОКАРДИОГРАММЫ У ПАЦИЕНТА ПОСЛЕ РАДИОЧАСТОТНОЙ АБЛАЦИИ ПЕРСИСТИРУЮЩЕЙ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ В СОЧЕТАНИИ С ОПЕРАЦИЕЙ КОРОНАРНОГО ШУНТИРОВАНИЯ
https://doi.org/10.57256/2949-0715-2025-4-1-18-28
Аннотация
Актуальность. Одной из самых распространенных в клинической практике аритмий является фибрилляция предсердий. Восстановление синусового ритма предпочтительно при данном виде аритмии. Проведение операции радиочастотной аблации способствует улучшению прогноза и качества жизни пациента. Одномоментная коронарная реваскуляризация при персистирующей фибрилляции предсердий позволяет добиться ожидаемого результата. Однако, одномоментное проведение этих операций способно увеличить риск послеоперационных осложнений, в том числе и рецидива аритмии. Амбулаторное ведение таких пациентов затруднено, так как нет четких схем антиаритмической терапии в зависимости от коморбидного статуса пациента.
Клиническое наблюдение. В данной статье представлен клинический случай послеоперационного ведения пациента 62 лет после радиочастотной аблации аритмогенных зон и резекции ушка левого предсердия при персистирующей фибрилляции предсердий, совмещенной с операцией коронарного шунтирования с помощью одноканального монитора электрокардиограммы в чехле смартфона.
Заключение. Дистанционный телеметрический контроль электрокардиограммы в чехле смартфона CardioQVARK прост в использовании, позволяет получить дополнительную информацию о работе сердечно-сосудистой системы. Ранее выявление рецидивов аритмии позволяет врачу оптимизировать проводимую антиаритмическую терапию, улучшить прогноз заболевания и качество жизни пациентов. Использование современного неинвазивного телеметрического контроля электрокардиограммы является перспективным направлением развития кардиологии. Оно может улучшить качество медицинской помощи и повысить эффективность лечения пациентов с сердечно-сосудистыми заболеваниями.
Ключевые слова
Для цитирования:
Гома Т.В. ТЕЛЕМЕТРИЧЕСКИЙ КОНТРОЛЬ ЭЛЕКТРОКАРДИОГРАММЫ У ПАЦИЕНТА ПОСЛЕ РАДИОЧАСТОТНОЙ АБЛАЦИИ ПЕРСИСТИРУЮЩЕЙ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ В СОЧЕТАНИИ С ОПЕРАЦИЕЙ КОРОНАРНОГО ШУНТИРОВАНИЯ. Байкальский медицинский журнал. 2025;4(1):18-28. https://doi.org/10.57256/2949-0715-2025-4-1-18-28
For citation:
Goma T.V. TELEMETRIC MONITORING OF THE ELECTROCARDIOGRAM IN A PATIENT AFTER RADIOFREQUENCY ABLATION OF PERSISTENT ATRIAL FIBRILLATION IN COMBINATION WITH CORONARY ARTERY BYPASS GRAFTING. Baikal Medical Journal. 2025;4(1):18-28. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-1-18-28
Актуальность
Фибрилляция предсердий (ФП) – одна из самых распространенных аритмий, встречающихся в клинической практике. Заболеваемость ФП во всем мире остается высокой и напрямую связана с возрастом пациентов. Ожидается, что распространенность данной аритмии как минимум удвоится в ближайшей перспективе. Это связано, как со старением населения и увеличением распространенности тесно связанных с ФП заболеваний, таких как ишемическая болезнь сердца (ИБС), сахарный диабет и артериальная гипертензия (АГ), так и с появлением новых технологий для диагностики и лечения [1,2]. Клиническая картина данной аритмии гетерогенна: от бессимптомного течения до крайне выраженных жизнеугрожающих симптомов. Однако, даже при минимальных проявлениях широко известно бремя ФП – тромбоэмболические осложнения, в том числе инсульты и субклинические повреждения головного мозга, сердечная недостаточность и увеличение показателя сердечно-сосудистой смертности от всех причин.
Лечение ФП складывается из следующих целей: контроль симптомов, уменьшение риска тромбоэмболических осложнений, профилактика развития сердечной недостаточности и улучшение качества жизни. Предпочтительной стратегией для достижения этих целей при пароксизмальной и персистирующей ФП является стратегия контроля синусового ритма. Применение антиаритмических препаратов ограничено их побочными эффектами и отсутствием стойкого действия. Радиочастотная катетерная аблация является наиболее результативным способом сохранения синусового ритма, уменьшением количества повторных госпитализаций и лучшими показателями качества жизни, в том числе у пациентов с сердечной недостаточностью со сниженной фракцией выброса [1, 2, 3, 4, 5, 6, 7]. Так, при анализе историй болезни 303 пациентов с пароксизмальной ФП в течение 1 года после аблации, хирургическое лечение показало свое преимущество в отношении возникновения рецидивов тахиаритмии по сравнению с артиаритмической терапией [8]. В отношении персистирующей ФП преимущества хирургических методов над медикаментозной терапией являются предметом дискуссий [2]. Так, в крупном многоцентровом исследовании CABANA с участием более двух тысяч пациентов с симптомной ФП стратегия катетерной аблации не показала преимущества по конечным точкам по сравнению с консервативным лечением [9]. При опросе врачей 326 врачей, большинство из которых работали на территории России, проведенном в декабре 2020 - январе 2021 гг, предпочтение стратегии контроля синусового ритма отдавали 50 % специалистов. Ожидаемые результаты успеха катетерной аблации составили 50 (30-60 %), риск осложнений при данном вмешательстве был 5 (1-10) % [10]. В зарубежных исследованиях риск неблагоприятных событий в перипроцедурный период составил 2,9-7,2 %, а показатель 30-дневной смертности был крайне низкий (менее 0,1 %) [11, 12, 13]. Авторы единодушны в том, что проведение хирургического лечения опытными специалистами в крупных кардиохирургических центрах значительно способствует успеху проводимого лечения.
Добиться ожидаемого результата при катетерной аблации персистирующей ФП помогает тщательный отбор пациентов на операцию и послеоперационное наблюдение. С высокой частотой рецидива аритмии ассоциированы возраст, наличие тяжелой сердечно-сосудистой патологии, ожирение, синдром обструктивного апноэ сна, непароксизмальная ФП (в частности, длительно-существующая персистирующая), расширение и фиброз левого предсердия (ЛП), дополнительные линейные аблации в ЛП, характер антиаритмической терапии [5, 14, 15, 16]. Тщательный контроль данных факторов в послеоперационном периоде способствует благоприятному исходу проводимого лечения. Бесспорно, реваскуляризация при атеросклерозе коронарных артерий должна способствовать успеху операции. Однако, ФП осложняет открытую реваскуляризацию миокарда достаточно часто (в 5-10 % случаев) [17, 18]. Одномоментное выполнение радиочастотной аблации и коронарного шунтирования может способствовать как неблагоприятным, так и благоприятным исходам лечения [17, 18, 19, 20].
Особенно важен период в течение трех месяцев после проведенной аблации, который называют «слепым». Рецидив аритмии в течение этого периода имеет прогностическую ценность и влияет на длительность и характер проводимой антиаритмической терапии [5, 10, 14, 15, 21, 22]. Традиционно в послеоперационном периоде используется прерывистый контроль электрокардиограммы (ЭКГ), который не всегда позволяет достоверно определить рецидив аритмии. Последние технологические разработки, такие как имплантируемые петлевые регистраторы, носимые пластыри, SMART-часы, фотоплетизмография, а также телеметрический контроль могут играть новую роль в мониторинге частоты послеоперационных осложнений [2]. ЭКГ, регистрируемая с помощью смартфона, интерпретируется искусственным интеллектом, имеет достаточную чувствительность и специфичность в отношении возникновения патологических аритмий в разных возрастных категориях [23, 24, 25].
В данной статье представлен клинический случай послеоперационного ведения пациента 62 лет после радиочастотной (РЧА) аблации аритмогенных зон и резекции ушка левого предсердия при персистирующей фибрилляции предсердий, совмещенной с операцией коронарного шунтирования с помощью одноканального монитора электрокардиограммы в чехле смартфона.
Клинический пример
Пациент С., мужчина, 62 лет впервые отметил появление болей за грудиной при физической нагрузке в начале 2024 года. Одышка при подъеме на 3 этаж, перебои за грудиной появились 6.02.2024 г. Синкопальные состояния отрицает. На ЭКГ в поликлинике по месту жительства выявлена персистирующая фибрилляция предсердий, тахисистолический вариант.
Из анамнеза: повышение артериального давления (АД) много лет. Максимальные подъемы АД до 180/ мм рт ст, привычные цифры до 140/90-100 мм рт ст. Вредные привычки отрицает. Инфаркт миокарда, инсульт, сахарный диабет, бронхиальную астму, хроническую обструктивную болезнь легких, патологию щитовидной железы, язвенную болезнь желудка и двенадцатиперстной кишки ранее не выявляли. Пациент наблюдается у онколога по поводу Рака кожи правой ушной раковины 1 ст Т1N0M0 2 клиническая группа. Рак сигмовидной кишки (аденокарцинома) рТ3N1сM0 G2 IIIb стадия III клиническая группа.
Рак кишечника выявлен в 2000 году. 27.08.2000 г выполнена левосторонняя гемиколонэктомия с формированием колостомы (обструктивная резекция). Проведено 8 курсов адъювантной полихимиотерапии по схеме XELOX с 30.03.2021 года. Лечение осложнилось возникновением токсической полинейропатии, дистальный тип, сенсо-моторная форма. 02.06.2021 г выполнена реконструкция толстой кишки с формированием межкишечного десцендо-ректоанастомоза. 2022 г – герниопластика. В 2023 г при контрольном обследовании выявлен базально-клеточный рак ушной раковины, проведена близкофокусная рентгенотерапия с положительной динамикой с рекомендацией дальнейшего наблюдения у онколога 1 раз в год.
При обследовании: в феврале 2024 года общий анализ крови и мочи – в норме. Общий холестерин 6,67 ммоль/л, холестерин липидов низкой плотности – 4,5 ммоль/л, холестерин липидов высокой плотности – 1,4 ммоль/л, скорость клубочковой фильтрации (CKD-EPI) – 54,4 мл/мин/1,73 м2, креатинин -128,7 мкмоль/л, мочевая кислота – 557,3 мкмоль/л (повышена), электролиты крови, коагулограмма, гормоны щитовидной железы – без отклонений.
ЭКГ в динамике: ритм ФП с частотой сердечных сокращений (ЧСС) 80-160 в мин. Горизонтальное положение электрической оси сердца. Нарушение процессов реполяризации.
Эхокардиография (февраль 2024 г): левое предсердие 46 × 54 мм, правое предсердие 43 × 49 мм, конечно-диастолический размер 4,8 см, конечно-систолический размер 2,9 см, фракция выброса 50 % (метод Симпсона), межжелудочковая перегородка 0,9 см, задняя стенка левого желудочка 0,9 см. Зоны диссенергии: в динамике не выявлено. Аортальный клапан: трёхстворчатый, створки – фиброз, уплотнены, на створках патологических образований не выявлено. Заключение: Нарушение ритма. Дегенеративные изменения аортального клапана. Дилатация левого и правого предсердия. Признаки легочной гипертензии.
Холтеровское мониторирование сердечного ритма и суточное мониторирование артериального давления (АД) февраль 2024 г: фибрилляция предсердий с ЧСС 70 до 176 ударов в минуту. Средняя ЧСС для желудочков днем 100, ночью 80 ударов в мин. Тахикардия в течение суток. Зарегистрированы одиночные желудочковые полиморфные экстрасистолы (всего 688, 30 в час, из них ночью 336, 32 в час), парные желудочковые мономорфные экстрасистолы (2). Пауза на фоне ФП до 2396 сек (1). Диагностически значимых изменений сегмента ST не зарегистрированы. Цифры систолического и диастолического АД в течение суток в пределах нормы. Циркадный индекс систолического АД – 6 %, диастолического АД 5 %. Снижение дастолического АД ночью недостаточное (нондиппер), наблюдалось увеличение систолического АД (найтпикер). Циркадный индекс в норме – 10-20 %.
Дуплексное сканирование экстракраниальных отделов брахиоцефальных артерий и подвздошно-бедренных сегментов артерий нижних конечностей (02.2024 г) – признаки стенозирующего атеросклероза сонных и бедренных артерий справа и слева до 35 %.
Коронарография 11.09.2024 г – Правый тип коронарного кровотока. Ствол левой коронарной артерии: стеноз в пятом сегменте в трифуркации более 50 %. Передняя нисходящая артерия (ПНА): стеноз в восьмом сегменте 50 %. Огибающая артерия (ОА): окклюзионно-стенотических поражений не выявлено. Правая коронарная артерия (ПКА): окклюзионно-стенотических поражений не выявлено.
Консультация кардиохирурга 11.09.2024 г: в связи с невозможностью черезкожного коронарного вмешательства, показано аорто-коронарное шунтирование.
Выставлен диагноз: Основное заболевание. ИБС. Фибрилляция предсердий персистирующая CHA2DS2VASc- 2 балла, HAS-BLED – 1 балл. Стенокардия напряжения 2 функциональный класс. Кардиокоронарография 11.09.2024 г – правый тип коронарного кровотока, стеноз ствола левой коронарной артерии в пятом сегменте в трифуркации более 50 %, стеноз передней нисходящая артерия в восьмом сегменте 50 %.
Осложнения: Хроническая сердечная недостаточность с сохраненной фракцией выброса, 1 стадии, функциональный класс 2.
Сопутствующие заболевания: Гипертоническая болезнь контролируемая, III стадии, риск IV (пол, возраст, дислипидемия, окружность талии более 102 см, ишемическая болезнь сердца, церебральный атеросклероз). Целевой уровень АД 120-139/70-79 мм рт ст. Рак кожи правой ушной раковины 1 ст Т1N0M0 2 клиническая группа. Рак сигмовидной кишки (аденокарцинома) рТ3N1сM0 G2 IIIb стадия III клиническая группа.
Пациент получал терапию Лозартаном 12,5 мг в сут, Аторвастатином 40 мг, Бисопролом 7,5 мг/сут, Дигоксином 0,25 мкг ½ таблетки при ЧСС более 80 ударов в минуту в покое, Апиксабаном 5 мг 2 раза в сут, Аллопуринолом 100 мг 1 раз в сут под контролем уровня мочевой кислоты. На фоне проводимой терапии чувствовал себя удовлетворительно. При обследовании в ноябре 2024 г целевой уровень холестерина липидов низкой плотности не был достигнут и составил 3,07 ммоль/л. Общий анализ крови и мочи были в норме.
На ЭКГ в ноябре 2024 г: ритм ФП 68-100 в минуту (нормосистолический вариант). Одиночные желудочковые экстрасистолы. Нарушение внутрижелудочковой проводимости.
Холтеровское мониторирование ЭКГ 22.11.2024 в динамике сохранение ритма ФП с ЧСС от 42 до 153 в мин. Средняя ЧСС днем 74, ночью – 63 в мин. Регистрировались одиночные полиморфные желудочковые экстрасистолы (139), короткий (4 комплекса) пароксизм мономорфной желудочковой тахикардии с ЧСС от 111 до 126 в минуту. Пауз более 3 секунд не выявлено, Зарегистрирован короткий эпизод депрессии сегмента ST до 1,2 мм в отведениях от верхушечно-боковой области при физической нагрузке (подъем по лестнице), длительностью 1 минута при ЧСС 135 в минуту.
Эхокардиография 29.11.2024 г: на фоне аритмии (ФП) расширены полости обоих предсердий (правое 5,7 × 6,2 см, площадь 27,7 см2, левое предсердие 5,0 ×6,4 см, площадь 33,0 см2, объем 57,41 мл/м2). Септальных дефектов не выявлено. Гипертрофия миокарда левого желудочка умеренная (толщина межжелудочковой перегородки 1,5 см. Сократительная функция незначительно снижена. Конечно-диастолический объем 130 мл. Фракция выброса 48-49 %. Очаговый склероз миокарда левого желудочка.
2.12.2024 г на базе ФГБУ «Национальный медицинский исследовательский центр имени академика Е.Н. Мешалкина» Министерства здравоохранения Российской федерации пациенту проведена операция маммарокоронарного шунтирования передней нисходящей артерии левой внутренней грудной артерией in situ. Аортокоронарное аутовенозное шунтирование промежуточной артерии. Радиочастотная аблация по схеме MAZE IV с использованием системы ArtiCure BP и ArtiCure CryoIce в условиях искусственного кровообращения. Выключение (резекция) ушка левого предсердия.
В раннем послеоперационном периоде сохранялась атрио-вентрикулярная блокада, проводилась временная электростимуляция. Самочувствие было стабильным, ангинозные приступы не беспокоили. Послеоперационная анемия скорректирована препаратами железа. Грудина стабильная. Заживление послеоперационных швов первичным натяжением, воспалительных изменений не было. Постепенное расширение физической нагрузки переносил удовлетворительно.
При контрольной эхокардиографии 19.12.2024 – систолическая функция левого желудочка не снижена, конечно-диастолический объем 108 мл, конечно-систолический объем 41 мл. В полости перикарда эхонегативных пространств нет, в плевральных синусах – свободная жидкость 1,2 см справа, 3,5 см слева.
По холтеровскому мониторированию ЭКГ 13.12.2024 и 18.12.2024 г- синусовый ритм, зафиксированы 3 эпизода фибрилляции предсердий длительностью 26 мин с ЧСС 72-104 в мин. Значимых пауз и смещений сегмента ST не зарегистрировано.
После выписки из стационара пациент чувствовал себя удовлетворительно. Перебои в сердце, ангинозные боли не беспокоили. Одышка возникает при быстрой ходьбе.
Объективный статус: Сознание ясное, в пространстве и времени ориентирован. Положение активное. Рост 191 см, вес 100 кг. Индекс массы тела (ИМТ) 27,41 кг/м2 (избыточная масса тела). Окружность талии – 105 см. Температура тела в норме. Нормостеник. Подкожно-жировая клетчатка развита избыточно. Кожный покров чистый, обычной окраски. Видимые слизистые обычной окраски и влажности. Тургор кожи сохранен. Периферические лимфатические узлы не увеличены, при пальпации безболезненные. Дыхание в легких везикулярное, проводится во все отделы легких, хрипы не выслушиваются. Частота дыхательных движений (ЧДД) 14 в минуту. Сатурация 97-98 %. Язык влажный, чистый. Живот мягкий, безболезненный. Печень не выходит из-под края реберной дуги. Симптом «поколачивания» отрицательный с обеих сторон.
Сердечно-сосудистая система: Область сердца внешне не изменена. Пульсация яремных вен – нет. Грудная клетка безболезненная при пальпации. Верхушечный толчок в 5 межреберье по средне-ключичной линии. Тоны сердца ритмичные, 65 в минуту. Артериальное давление по дневнику 120-130/70-75 мм рт ст на обеих руках. При аускультации шумы сердца достоверно не выслушиваются.
Пациент получает терапию: Т. Ацетилсалициловая кислота 75 мг, Апиксабан 5 мг 2 раза в сутки, Т. Амиодарон 200 мг 1 раз в сутки 5 дней (суббота-воскресенье перерыв), Т. Периндоприл 5 мг, Спиронолактон 25 мг или Эплеренон 25 мг, Дапаглифлозин 10 мг, Розувастатин 20 мг. С учетом показателей липидного спектра к терапии рекомендовано добавление Эзетимиба 10 мг 1 раз в сут.
При контрольной ЭКГ амбулаторно 20.01.2025 г регистрировался синусовый ритм с ЧСС 78 в мин. Снижение вольтажа QRS. Межпредсердная блокада 1 степени. Нарушение процессов реполяризации без динамики.
Эхокардиография 20.01.2025 г: фракция выброса 51 % (метод Симпсона). Умеренная гипокинезия межжелудочковой перегородки, тенденция к дилатации полости левого желудочка. Дилатация левого предсердия (5,1 × 5,1 см).
Пациент ежедневно мониторирует ЭКГ с помощью одноканального монитора CardioQVARK (ООО «КардиоКВАРК», Россия), где определялся синусовый ритм (СР) с ЧСС 70-75 уд/мин (рис. 1).
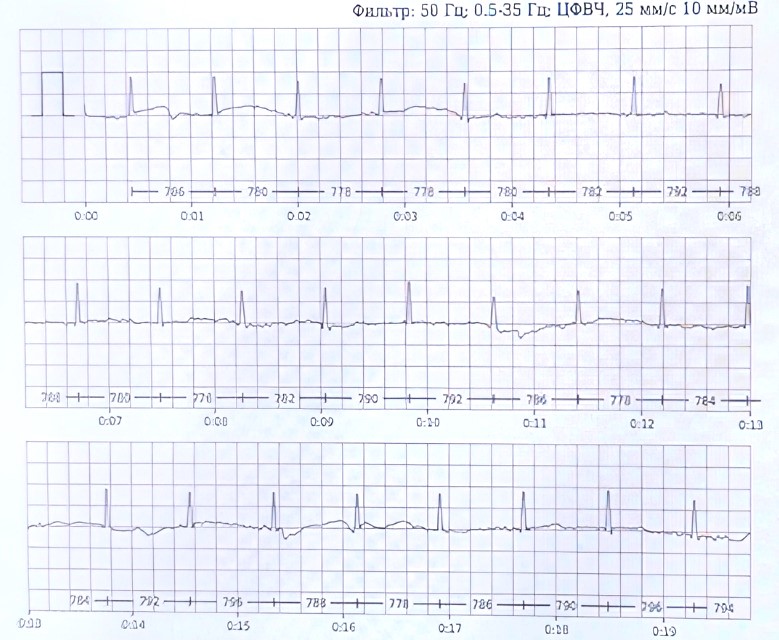
Рис. 1. Электрокардиограмма, зарегистрированная с помощью одноканального монитора CardioQVARK (ООО «КардиоКВАРК», Россия) у пациента С, 62 лет
Система позволяет ежедневно мониторировать ЭКГ, выявлять возникающие аритмии, она проста в использовании. Записи можно смотреть на смартфоне с помощью специального приложения и передавать на другие устройства. При сопоставлении ЭКГ, записанного классическим способом и с помощью монитора CardioQVARK существенных различий регистрируемых параметров не выявлено. В отчете анализируются различные параметры, которые позволяют своевременно скорректировать проводимую терапию (рис. 2).
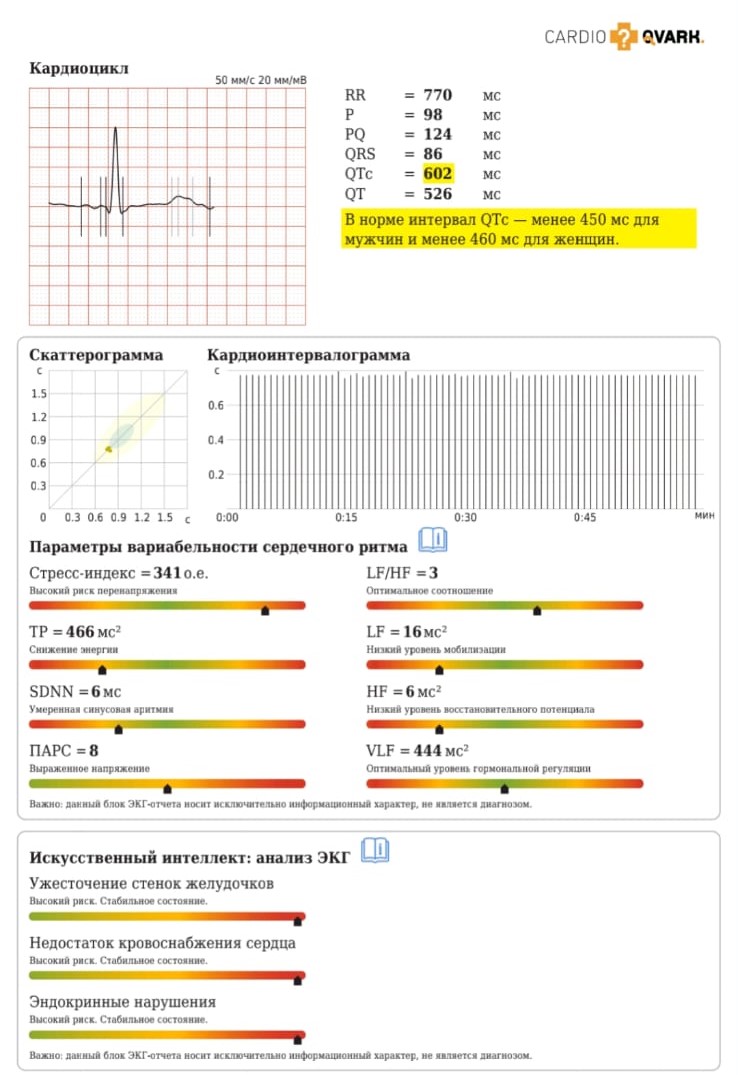
Рис. 2. Пример анализа электрокардиограммы, зарегистрированной с помощью одноканального монитора CardioQVARK у пациента С, 62 лет
Обсуждение
Катетерная аблация ФП является довольно распространенной операцией. Так, в Российской Федерации проводится около 8 000-10 000 операций в год, однако это количество не соответствует истинной потребности [26]. Эффективность хирургического лечения составляет около 66 %, от 20 до 50 % пациентов может потребоваться повторное вмешательство, что особо актуально у пациентов с персистирующей фибрилляцией предсердий [5, 15].
В приведенном клиническом примере продемонстрирован пациент 62 лет с персистирующей ФП. Из анамнеза известно, что пациент страдал неконтролируемой артериальной гипертензией и дислипидемией. Также пациент наблюдался у онколога по поводу рака кишечника, получал химиотерапию, оперативное лечение, что, вероятно, повлияло на состояние сердечно-сосудистой системы. Ишемическая болезнь сердца была диагностирована одновременно с дебютом ФП.
При обследовании выявлена дилатация предсердий, которая прогрессировала, несмотря на проводимую терапию. Показано, что контроль ритма при ФН в ряде случаев может способствовать обратному ремоделированию предсердий [6]. Однако, общепризнанным является факт, что наличие дилатации предсердий, как и персистенция аритмии и ишемической болезни сердца, является предиктором, снижающим вероятность положительного ответа на хирургическое лечение [1, 2, 5].
РЧА – это метод, при котором создается трансмуральное повреждение миокарда аритмогенных зон, однако термическая травма может привести к повреждению и некрозу прилегающих тканей, способствовать тромбозу и тромбоэмболии [27]. Одномоментная операция коронарной реваскуляризации может способствовать улучшению клинических результатов и прогноза [1, 2, 28]. Но выполнение этих двух операций одновременно способно увеличить риск осложнений из-за технического усложнения операции, дополнительных манипуляций, увеличении времени окклюзии аорты. Эти факторы приводят к тому, что в настоящее время число одномоментных операций ограничено [28, 29].
В раннем послеоперационном периоде рецидивы ФП встречаются довольно часто, однако считается, что в большинстве случаев они проходят самостоятельно [5, 30. 31]. В раннем послеоперационном периоде у пациента С. при холтеровском мониторировании ЭКГ зафиксированы 3 эпизода ФП длительностью не более 30 минут. Появление аритмии, вероятно, связано с «электрофизиологической памятью» предсердий вследствие длительной персистенции ФП и транзиторными изменениями в кардиомиоцитах. Однако в ряде исследований показано, что раннее рецидивирование ФП увеличивает риск отдаленного возобновления аритмии [32, 33].
Для подавления рецидивов аритмии в течение трех месяцев после оперативного лечения рекомендовано использовать антиаритмическую терапию [1, 2]. В представленном клиническом примере пациент получает амиодарон 200 мг в сутки. Однако, четких схем антиаритмической терапии у пациентов после РЧА при сочетанной патологии не существует, продолжительность антиаритмической терапии может быть 6-12 месяцев и более. Сроки приема определяются индивидуально с учетом сопутствующей патологии и побочных эффектов терапии. При этом убедительные данные о пользе и риске продолжения приема антиаритмических препаратов после «слепого периода» отсутствуют [1, 2, 5].
Использование современных методов удаленного мониторинга ЭКГ может значительно повлиять на эту проблему [2, 23, 24, 25]. Устройства просты в использовании и позволяют проводить раннюю диагностику и быструю оценку соответствующих проблем, как клинических, так и технических, а также дополнять амбулаторное наблюдение, улучшая контроль над заболеванием без ущерба для безопасности. Помимо клинических преимуществ, удаленный мониторинг продемонстрировал экономическую эффективность и связан с повышенным уровнем удовлетворенности пациентов [34]. Ежедневный телеметрический контроль ЭКГ в данном клиническом наблюдении проводился с помощью дистанционного одноканального монитора электрокардиограммы в чехле смартфона CardioQVARK. Использование этого устройства не вызывает затруднений и достаточно надежно, что было продемонстрировано как для скрининга ФП у пациентов с высоким сердечно-сосудистым риском, так и у пациентов с сердечной недостаточностью [35, 36].
Заключение
В настоящее время известно, что одномоментное хирургическое лечение ФП и коронарная реваскуляризация способны улучшить прогноз и качество жизни пациентов, однако также данные операции сопровождаются повреждением миокарда. Дистанционный неинвазивный мониторинг ЭКГ позволяет выявить рецидив аритмии, а также оптимизировать проводимую антиаритмическую терапию. Одноканальный монитор электрокардиограммы в чехле смартфона CardioQVARK прост в использовании и надежен. Телеметрический контроль ЭКГ может стать дополнительным инструментом для врачей-кардиологов и терапевтов при амбулаторном ведении пациентов очень высокого сердечно-сосудистого риска, улучшать взаимодействие между врачом и пациентом и приверженность к терапии.
Список литературы
1. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594 [Arakelyan M.G., Bockeria L.A., Vasilieva E.Yu. et al. 2020 Clinical guidelines for Atrial fibrillation and atrial flutter. Russian Journal of Cardiology. 2021;26(7):4594 (In Russ.)]. https://doi.org/10.15829/1560-4071-2021-4594
2. Van Gelder I.C., Rienstra M., Bunting K.V. et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2024;45(36):3314-3414. https://doi.org/10.1093/eurheartj/ehae176
3. Morillo C.A., Verma A., Connolly S.J. et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial [published correction appears in JAMA. 2014;311(7):692-700. https://doi.org/10.1001/jama.2014.467
4. Packer D.L., Kowal R.C., Wheelan K.R. et al. Cryoballoon ablation of pulmonary veins for paroxysmal atrial fibrillation: first results of the North American Arctic Front (STOP AF) pivotal trial. J Am Coll Cardiol. 2013;61(16):1713-1723. https://doi.org/10.1016/j.jacc.2012.11.064
5. Михайлов Е.Н., Гасымова Н.З., Айвазьян С.А. и др. Факторы, ассоциированные с эффективностью радиочастотной катетерной аблации фибрилляции предсердий: мнение специалистов, применяющих технологию «Индекс Аблации». Вестник аритмологии. 2020;27(3): 9-24 [Mikhaylov E.N., Gasimova N.Z., Ayvazyan S.A. et al. Factors associated with the efficacy of atrial fibrillation radiofrequency catheter ablation: opinion of the specialists who use the “ablation index” module. Journal of Arrhythmology. 2020;27(3):9-24 (In Russ.)]. https://doi.org/10.35336/VA-2020-3-9-24
6. Marrouche N.F., Brachmann J., Andresen D. et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. New England Journal of Medicine. 2018;378(5): 417-27. https://doi.org/10.1056/NEJMoa1707855
7. Гасымова Н.З., Михайлов Е.Н., Оршанская В.С. и др. Обратное ремоделирование сердца после катетерной аблации фибрилляции предсердий у пациентов с сердечной недостаточностью и низкой фракцией выброса левого желудочка. Кардиология. 2019;59(8S):37-43 [Gasimova N.Z., Mikhaylov E.N., Orshanskaya V.S. et al. Reverse remodelling of the heart after atrial fibrillation ablation in patients with heart failure with reduced ejection fraction. Kardiologiia. 2019;59(8S):37-43 (In Russ.)]. https://doi.org/10.18087/cardio.2671
8. Andrade J.G., Wells G.A., Deyell M.W. et al. Cryoablation or Drug Therapy for Initial Treatment of Atrial Fibrillation. N Engl J Med. 2021;384(4):305-315. https://doi.org/10.1056/NEJMoa2029980
9. Packer D.L., Mark D.B., Robb R.A. et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019;321(13):1261-1274. https://doi.org/10.1001/jama.2019.0693
10. Шубик Ю.Б., Медведев М.М., Михайлов Е.Н., Гасымова Н.З., Гиляров М.Ю. Лечение фибрилляции предсердий в России: реальная клиническая практика и рекомендации. Вестник аритмологии. 2021;28(2): 55-63 [Shubik Yu.V., Medvedev M.M., Mikhaylov E.N., Gasimova N.Z., Gilyarov M.Yu. Management of atrial fibrillation in Russia: real clinical practice and current clinical guidelines. Journal of Arrhythmology. 2021;28(2):55-63 (In Russ.)]. https://doi.org/10.35336/VA-2021-2-55-63
11. Wu L., Narasimhan B., Ho K.S. et al. Safety and complications of catheter ablation for atrial fibrillation: Predictors of complications from an updated analysis the National Inpatient Database. J Cardiovasc Electrophysiol. 2021;32(4):1024-1034. https://doi.org/10.1111/jce.14979
12. Cheng E.P., Liu C.F., Yeo I. et al. Risk of Mortality Following Catheter Ablation of Atrial Fibrillation. J Am Coll Cardiol. 2019;74(18):2254-2264. https://doi.org/10.1016/j.jacc.2019.08.1036
13. Tripathi B., Arora S., Kumar V. et al. Temporal trends of in-hospital complications associated with catheter ablation of atrial fibrillation in the United States: An update from Nationwide Inpatient Sample database (2011-2014). J Cardiovasc Electrophysiol. 2018;29(5):715-724. https://doi.org/10.1111/jce.13471
14. Михайлов Е.Н., Гасымова Н.З., Байрамова С.А. и др. Клиническая характеристика пациентов и результаты катетерной аблации фибрилляции предсердий в российской популяции: субанализ европейского регистра 2012-2016гг. Российский кардиологический журнал. 2018;(7):7-15 [Mikhailov E.N., Gasymova N.Z., Bayramova S.А. et al. Clinical characteristics of patients and results of catheter ablation in atrial fibrillation in Russia: subanalysis of the European registry 2012-2016. Russian Journal of Cardiology. 2018;(7): 7-15 (In Russ.)]. https://doi.org/10.15829/1560-4071-2018-7-7-15.
15. Московских Т.В., Сморгон А.В., Усенков С.Ю. и др. Предикторы ранних рецидивов предсердных тахиаритмий после катетерной аблации фибрилляции предсердий. Вестник аритмологии. 2024;31(4):38-46 [Moskovskih T.V., Smorgon A.V., Usenkov S.Yu. et al. Predictors of early recurrence of atrial tachyarrhythmias after catheter ablation of atrial fibrillation. Journal of Arrhythmology. 2024;31(4):38-46]. https://doi.org/10.35336/VA-1392
16. Пономаренко А.В., Кривошеев Ю.С., Михеенко И.Л. и др. Поиск потенциальных факторов, ассоциированных с неуспехом катетерной аблации фибрилляции предсердий. Ретроспективный анализ электронных медицинских карт при помощи сервиса поддержки принятия врачебных решения (исследование СЕЛЕКТ ФП). Кардиологический вестник. 2023;18(2):35–42 [Ponomarenko A.V., Krivosheev Y.S., Mikheenko I.L. et al. Searching for potential factors associated with failed catheter ablation of atrial fibrillation. Retrospective analysis of electronic medical records using medical decision making support service (SELECT AF study). Russian Cardiology Bulletin. 2023;18(2):35 42 (In Russ.)]. https://doi.org/10.17116/Cardiobulletin20231802135].
17. Malaisrie S.C., McCarthy P.M., Kruse J. et al. Ablation of atrial fibrillation during coronary artery bypass grafting: Late outcomes in a Medicare population. J Thorac Cardiovasc Surg. 2021;161(4):1251-1261.e1. https://doi.org/10.1016/j.jtcvs.2019.10.159
18. McCarthy P.M., Davidson C.J., Kruse J. et al. Prevalence of atrial fibrillation before cardiac surgery and factors associated with concomitant ablation. J Thorac Cardiovasc Surg. 2020;159(6):2245-2253.e15. https://doi.org/10.1016/j.jtcvs.2019.06.062
19. Khiabani A.J., Adademir T., Schuessler R.B. et al. Management of Atrial Fibrillation in Patients Undergoing Coronary Artery Bypass Grafting: Review of the Literature. Innovations (Phila). 2018;13(6):383-390. https://doi.org/10.1097/IMI.0000000000000570.
20. Filardo G., Pollock B.D., da Graca B. et al. Lower Survival After Coronary Artery Bypass in Patients Who Had Atrial Fibrillation Missed by Widely Used Definitions. Mayo Clin Proc Innov Qual Outcomes. 2020 Dec 10; 4(6): 630-637. https://doi.org/10.1016/j.mayocpiqo.2020.07.012
21. Mohanty S., Mansour M., Natale A. Identifying the prog- nostic significance of early arrhythmia recurrence during the blanking period: a pursuit to rediscover the past. Europace. 2023;25(9): euad229. https://doi.org/10.1093/eu-ropace/euad229
22. Steinberg C., Champagne J., Deyell M.W. et al. CIR-CA-DOSE Study Investigators. Prevalence and outcome of early recurrence of atrial tachyarrhythmias in the Cryoballoon vs Irrigated Radiofrequency Cath eter Ablation (CIRCA-DOSE) study. Heart Rhythm. 2021;18(9): 1463-1470. https://doi.org/10.1016/j.hrthm.2021.06.1172
23. Haverkamp H.T., Fosse S.O., Schuster P. Accuracy and usability of single-lead ECG from smartphones - A clinical study. Indian Pacing Electrophysiol J. 2019;19(4):145-149. https://doi.org/10.1016/j.ipej.2019.02.006
24. Babar F., Cheema A.M., Ahmad Z. et al. Sensitivity and Specificity of Wearables for Atrial Fibrillation in Elderly Populations: A Systematic Review. Curr Cardiol Rep. 2023;25(7):761-779. https://doi.org/10.1007/s11886-023-01898-3
25. Manetas-Stavrakakis N., Sotiropoulou I.M., Paraskevas T. et al. Accuracy of artificial intelligence-based technologies for the diagnosis of atrial fibrillation: A systematic review and meta-analysis. J Clin Med. 2023;12(20):6576. https://doi.org/10.3390/jcm12206576
26. Hindricks G., Camm J., Merkely B. et al. The EHRA White Book 2017. The current status of cardiac electrophysiology in ESC member countries. URL: https://www.escardio.org/static_file/Escardio/Subspecialty/EHRA/Publications/Documents/2017/ehra-whitebook-2017.pdf [accessed: 03.02.2025].
27. Аванесян Г.А., Филатов А.Г. Биофизические аспекты аблации миокардиальной ткани при лечении пациентов с фибрилляцией предсердий. Анналы аритмологии. 2022;19(1):23-31 [Avanesyan G.A., Filatov A.G. Biophysical aspects of myocardial tissue ablation in the treatment of patients with atrial fibrillation Annals of Arrhythmology. 2022;19(1):23-31 (In Russ.)]. https://doi.org/10.15275/annaritmol.2022.1.4
28. Ревишвили А.Ш., Попов В.А., Малышенко Е.С., Анищенко М.М. Операции Лабиринт V для симультанного хирургического лечения фибрилляции предсердий при коронарном шунтировании. Минимально инвазивная сердечно-сосудистая хирургия. 2022;1(1):40-52 [Revishvili A.Sh., Popov V.A., Malyshenko E.S., Anishchenko M.M. Surgical Treatment of Atrial Fibrillation Concomitant to Coronary Artery Bypass Grafting: In-Hospital and Long-Term Results of Maze V Procedure. Minimally Invasive Cardiovascular Surgery. 2022;1(1):40-52 (In Russ.)]. URL: https://misss.elpub.ru/jour/article/view/6/6 [дата доступа 03.02.2025]
29. Бокерия Л.А., Бокерия О.Л., Биниашвили М.Б., Юркулиева Г.А., Гурина М.И. Сочетанная хирургия фибрилляции предсердий и ишемической болезни сердца. Анналы аритмологии. 2021;18(4):200-212 [Bockeria L.A., Bockeria O.L., Biniashvili M.B., Yurkulieva G.A., Gurina M.I. Concomitant surgery for atrial fibrillation and ischemic heart disease. Annals of Arrhythmology. 2021;18(4):200-212 (In Russ.)]. https://doi.org/10.15275/annaritmol.2021.4.1
30. Liang J.J., Dixit S., Santangeli P. Mechanisms and clinical significance of early recurrences of atrial arrhythmias after catheter ablation for atrial fibrillation. World J Cardiol. 2016;8(11): 638-646. https://doi.org/10.4330/wjc.v8.i11.638
31. Calkins H., Hindricks G., Cappato R. et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Heart Rhythm. 2017;14(10):e275-444. https://doi.org/10.1093/europace/eux274
32. Darden D., Aldaas O., Malladi C.L. et al. Association between early recurrences of atrial tachyarrhythmias and long-term outcomes in patients after repeat atrial fibrillation ablation. J Interv Card Electrophysiol. 2022;64(2):323-331. https://doi.org/10.1007/s10840-021-00987-z
33. Noujaim C., Lim C., Mekhael M. et al. Identifying the prognostic significance of early arrhythmia recurrence during the blanking period and the optimal blanking period duration: insights from the DECAAF II study. Europace. 2023;25(6):euad173. https://doi.org/10.1093/europace/euad173
34. Preda A., Falco R., Tognola C. et al. Contemporary Advances in Cardiac Remote Monitoring: A Comprehensive, Updated Mini-Review. Medicina (Kaunas). 2024;60(5):819. https://doi.org/10.3390/medicina60050819
35. Gognieva D., Vishnyakova N., Mitina Y. et al. Remote screening for atrial fibrillation by a federal cardiac monitoring system in primary care patients in Russia: Results from the Prospective Interventional Multicenter FECAS-AFS Study. Glob Heart. 2022;17(1):4. https://doi.org/10.5334/gh.1057
36. Захаров И.П., Чомахидзе П.Ш., Копылов Ф.Ю. и др. Определение риска развития пароксизма фибрилляции предсердий у пациентов с хронической сердечной недостаточностью с сохранной и сниженной фракцией выброса. Кардиология. 2024;64(3):25-33 [Zakharov I.P., Chomakhidze P.S., Kopylov F.Y. et al. Determining The Risk of Atrial Fibrillation Paroxysm in Patients With Chronic Heart Failure With Intact and Reduced Ejection Fraction. Kardiologiia. 2024;64(3):25-33 (In Russ.)]. https://doi.org/10.18087/cardio.2024.3.n2466
Об авторе
Татьяна Владимировна ГомаРоссия
к.м.н., доцент кафедры факультетской терапии ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России (664003, г. Иркутск, ул. Красного Восстания, 1, Россия)
Рецензия
Для цитирования:
Гома Т.В. ТЕЛЕМЕТРИЧЕСКИЙ КОНТРОЛЬ ЭЛЕКТРОКАРДИОГРАММЫ У ПАЦИЕНТА ПОСЛЕ РАДИОЧАСТОТНОЙ АБЛАЦИИ ПЕРСИСТИРУЮЩЕЙ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ В СОЧЕТАНИИ С ОПЕРАЦИЕЙ КОРОНАРНОГО ШУНТИРОВАНИЯ. Байкальский медицинский журнал. 2025;4(1):18-28. https://doi.org/10.57256/2949-0715-2025-4-1-18-28
For citation:
Goma T.V. TELEMETRIC MONITORING OF THE ELECTROCARDIOGRAM IN A PATIENT AFTER RADIOFREQUENCY ABLATION OF PERSISTENT ATRIAL FIBRILLATION IN COMBINATION WITH CORONARY ARTERY BYPASS GRAFTING. Baikal Medical Journal. 2025;4(1):18-28. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-1-18-28



















