Перейти к:
ВЛИЯНИЕ ПРЕПАРАТА ОМНИК НА ИНТЕНСИВНОСТЬ КЛЕТОЧНЫХ РЕАКЦИЙ В ОЧАГЕ ЭКСПЕРИМЕНТАЛЬНОГО ВОСПАЛЕНИЯ
https://doi.org/10.57256/2949-0715-2024-4-40-49
Аннотация
Актуальность. Препарат Омник (Тамсулозин) снижает тонус гладкой мускулатуры предстательной железы, шейки мочевого пузыря, простатической части уретры, улучшает отток мочи, уменьшает симптомы обструкции и раздражения мочевыводящих путей при ДГП. Однако данные о его противовоспалительном действии противоречивы и неконкретны.
Цель. Определить механизмы противовоспалительного действия препарата Омник на модели гнойного воспаления у крыс.
Материал и методы. Исследование проведено на 50 беспородных белых крысах-самцах, распределенных на 2 серии: 1 серия – контрольная (им имплантировали под кожу бедра диффузионные камеры, заполненные водной взвесью однодневной культуры staphylococcus aureus; 2 серия – опытная (животным этой серии моделировалось гнойное воспаление аналогично контролю, но с 1 суток воспаления крысам в/м вводили 0,02 мл препарата Омник в течение 10 дней). Забор материалы проводили через 2, 3, 5, 7, 10, 15, 20, 30, 60 суток после имплантации. Материал фиксировали в 10-процентном растворе нейтрального формалина. Морфометрическими методами оценивали интенсивность воспалительной реакции вокруг камеры. В периферической зоне очага воспаления качественно оценивали состояние микрососудов, подсчитывали концентрацию тучных клеток, эозинофилов, нейтрофилов, мононуклеаров и малодифференцированных фибробластов в 1000 мкм2.
Результаты. В опытной группе, получавшей препарат Омник, через 48 часов после начала воспаления вокруг стен-ки камер наблюдается клеточный вал толщиной 313,18 ± 30,19 мкм. Через 3 суток после введения камер толщина лейкоцитарного вала сохраняется и составляет 334,38 ± 25,69 мкм. Через 5 суток после начала воспаления толщи-на лейкоцитарного вала резко уменьшается по сравнению с предыдущим сроком и составляет 157,86 ± 46,08 мкм.
Через 7 суток после введения камер толщина клеточного вала увеличивается до 220 ± 29,67 мкм. На 10-е сутки от начала воспаления происходит уменьшение толщины вала до 129,52 ± 21,01 мкм. На 15-е сутки воспаления толщина и состояние лейкоцитарного вала не меняются. На 20–30–60-е сутки с момента имплантации камер вокруг них наблюдались остатки лейкоцитарного вала толщиной 117,86 ± 29,6 мкм.
Заключение. Влияние препарата Омник на динамику клеточных реакций в очаге воспаления усиливает миграционные способности лейкоцитов, концентрирует фибробласты вокруг лейкоцитарного вала. При этом синтез фибробластами коллагена не соответствует толщине соединительнотканной капсулы, что нарушает процесс созревания капсулы. Предположительно действия препарата Омник связано с влиянием препарата на тонус капилляров и венул.
Для цитирования:
Семинский И.Ж., Серебренникова С.Н., Ткачук Е.А., Васильев Ю.В. ВЛИЯНИЕ ПРЕПАРАТА ОМНИК НА ИНТЕНСИВНОСТЬ КЛЕТОЧНЫХ РЕАКЦИЙ В ОЧАГЕ ЭКСПЕРИМЕНТАЛЬНОГО ВОСПАЛЕНИЯ. Байкальский медицинский журнал. 2024;3(4):40-49. https://doi.org/10.57256/2949-0715-2024-4-40-49
For citation:
Seminsky I.Zh., Serebrennikova S.N., Tkachuk E.A., Vasiliev Yu.V. INFLUENCE OF THE DRUG OMNIC ON THE INTENSITY OF CELLULAR REACTIONS IN THE SPOTS OF EXPERIMENTAL INFLAMMATION. Baikal Medical Journal. 2024;3(4):40-49. (In Russ.) https://doi.org/10.57256/2949-0715-2024-4-40-49
Актуальность исследования
По данным ряда авторов препарат Омник (Тамсулозин) снижает тонус гладкой мускулатуры предстательной железы, шейки мочевого пузыря, простатической части уретры, улучшает отток мочи, уменьшает симптомы обструкции и раздражения мочевыводящих путей при ДГП [1,2,3]. Это достигается за счет селективной блокады постсинаптических a1А-адренорецепторов гладкой мускулатуры предстательной железы, шейки мочевого пузыря и простатической части уретры [4,5,6]. Способность блокировать a1А-АР в 20 раз больше по сравнению с действием на a1B-АР гладкой мускулатуры сосудов. [7,8,9].
В доступной литературе мы не нашли конкретных данных о влиянии препарата Омник на стадии воспалительного процесса, хотя клинические наблюдения свидетельствуют о снижении симптомов воспаления у больных, принимающих этот препарат. В связи с вышеизложенным в настоящем исследовании была поставлена цель – на модели гнойного воспаления у крыс определить механизмы противовоспалительного действия препарата Омник.
Материалы и методы исследования
Исследование проведено на 50 беспородных белых крысах-самцах массой 180-220 г. в осенне-зимний период. Содержание животных и постановка экспериментов проводилась в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 года и № 267 МЗ РФ от 19.06.2003 года, а также международных правил «Guide for the Careand Use of Laboratory Animals» и соответствовали «Правилам проведения работ с использованием экспериментальных животных», «Контролю за проведением работ с использованием экспериментальных животных» (приказ №742 и №48 Министерства высшего и среднего специального образования СССР от 13.11.1984г. и от 23.01.1985г.) и «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 18.03.1986г.) Животные содержались в условиях вивария, эксперимент проводился в соответствии с правилами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755). Все оперативные вмешательства проводились в асептических условиях.
Крыс распределили на 2 серии:
1 серия – контрольная. Животным под легким эфирным наркозом для моделирования гнойного воспаления имплантировали под кожу бедра диффузионные камеры собственной конструкции (патент № 5030684(010989) от 4.03.92), заполненные водной взвесью однодневной культуры staphylococcus aureus № 9198 в дозе 100 тыс. микробных тел на 1 камеру.
2 серия – опытная. Животным этой серии моделировалось гнойное воспаление аналогично контролю. С 1 суток воспаления крысам в/м вводили 0,02 мл препарата Омник в течение 10 дней. Доза препарата рассчитывалась как среднетерапевтическая: каждой крысе массой 180 - 220г вводили Омник в дозе, равной 0,012 мг, что соответствовало 0,02 мл раствора данного препарата.
Забор кусочков ткани с камерами проводили через 2, 3, 5, 7, 10, 15, 20, 30, 60 суток после имплантации. Материал фиксировали в 10-процентном растворе нейтрального формалина, подвергали стандартной гистологической обработке, кусочки заливали в парафин, срезы толщиной 7 мкм окрашивали гематоксилин-эозином и по Ван-Гизону.
В очаге воспаления вокруг камер на светооптическом уровне по разработанной методике (Семинский И.Ж., Клейн К.Л., Дедюх А.В., 1991 г.) морфологически оценивали динамику клеточных реакций. Количественно регистрировали толщину лейкоцитарного вала вокруг стенки камеры, концентрацию клеток в вале, соотношение клеточных популяций, толщину фибробластической капсулы вокруг лейкоцитарного вала, число слоев фибробластов, концентрацию фибробластов в капсуле (рис. 1).
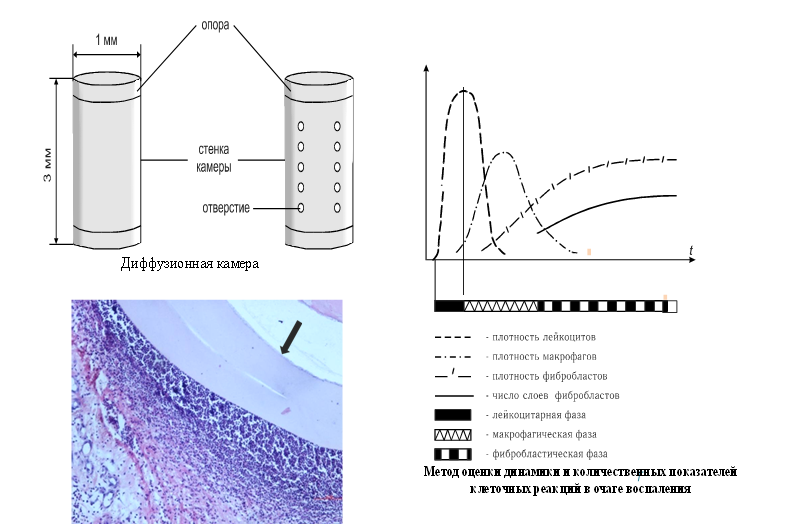
Рис. 1. Метод оценки клеточных реакций в очаге воспаления
В периферической зоне очага воспаления качественно оценивали состояние микрососудов, подсчитывали концентрацию тучных клеток, эозинофилов, нейтрофилов, мононуклеаров и малодифференцированных фибробластов.
На 2 и 15 сутки после начала воспаления определяли фагоцитарный индекс, фагоцитарное число лейкоцитов, находящихся внутри камеры. Для этого дно камеры вскрывалось, изготовлялся мазок, который фиксировали смесью Никифорова, высушивали на воздухе и окрашивали по методу Романовского-Гимза. Цифровые данные обработаны стандартными методами вариационной статистики и считались достоверными при р ≤ 0,05.
Результаты собственных исследований
Динамика воспалительного процесса у контрольных животных
Через 48 ч после повреждения толщина клеточного вала вокруг камеры составляет 118,2 ± 18 мкм, происходит массовая гибель нейтрофилов в вале, которая сопровождается фагоцитированием их макрофагами (рис. 2, 3, 4).
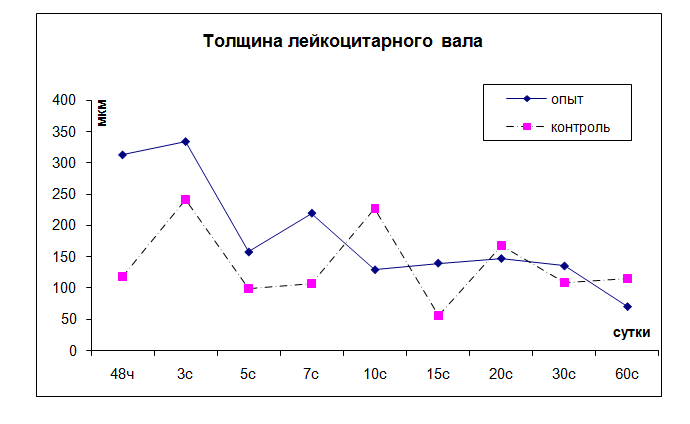
Рис. 2. Динамика толщины лейкоцитарного вала вокруг камеры
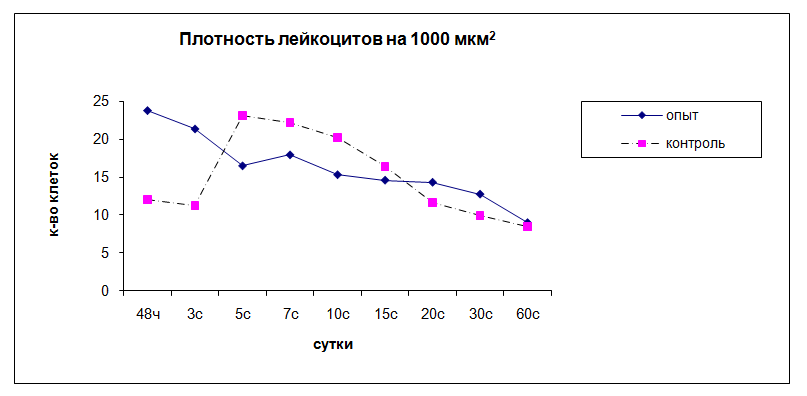
Рис. 3. Динамика плотности лейкоцитов в очаге воспаления
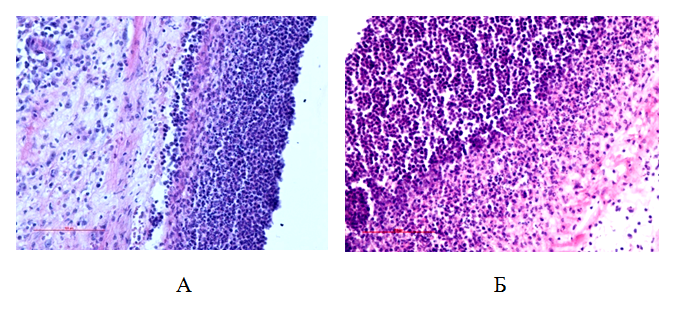
Рис.4. Лейкоцитарный вал вокруг стенки камеры у контрольных (А) и опытных (Б) животных. 48ч от начала воспаления
Соотношение нейтрофил: макрофаг = 1 : 1. Состояние фагоцитоза лейкоцитов: ФЧ = 4,59 ± 0,3 микробных тел; ФИ = 49 ± 3% (рис. 5, 6).
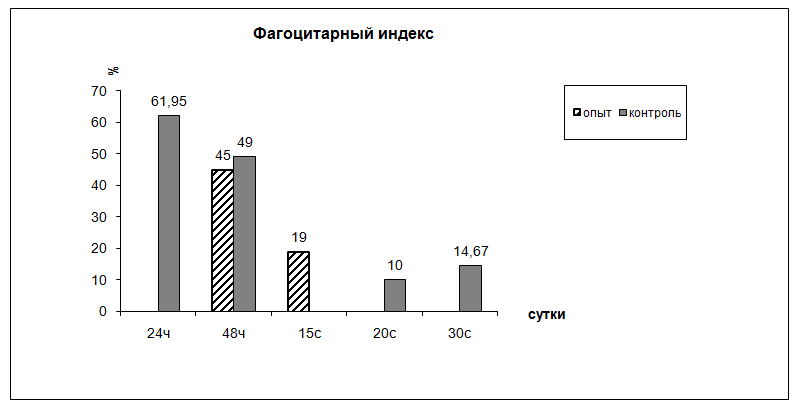
Рис. 5. Динамика фагоцитарного индекса лейкоцитов внутри камеры
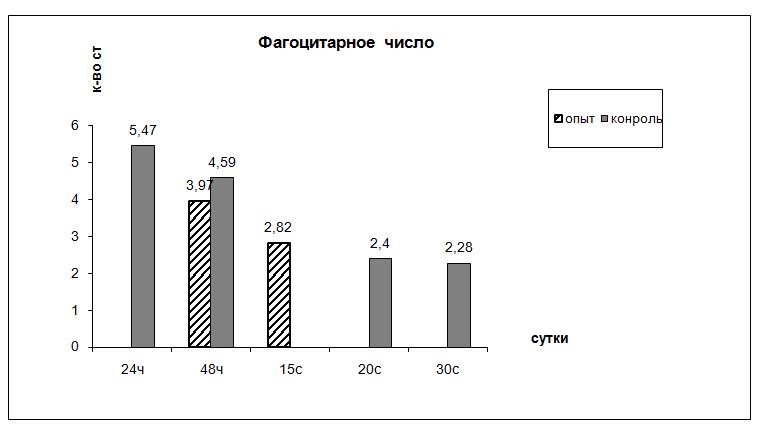
Рис. 6. Динамика фагоцитарного числа лейкоцитов внутри камеры
В отдаленной зоне на этот срок концентрация лейкоцитов составляет на 8 ± 1,1 на 1000 мкм2, 50% представлено нейтрофилами, 50% - мононуклеарами. Наблюдается расширение и полнокровие сосудов, начинают появляться малодифференцированные фибробласты (рис.7).
Рис.7. Отдаленная зона очага воспаления у опытных животных. 48ч от начала воспаления
Через 3 суток после введения камеры непосредственно около ее стенки продолжается накопление лейкоцитов, плотность которых составляет 11,2 ± 2,2 на 1000 мкм2, толщина клеточного вала 241,2 ± 16 мкм, в нем преобладают моноциты и макрофаги – 75%, 25% - нейтрофилы. Продолжается интенсивный аутолиз нейтрофилов и фагоцитоз их фрагментов макрофагами. По периферии лейкоцитарного вала появляется тонкая фибробластическая капсула, состоящая из 1-2 параллельно ориентированных слоев клеток (рис. 8, 9).
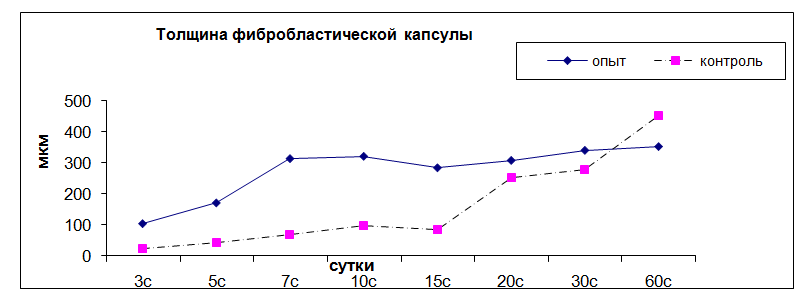
Рис. 8. Динамика толщины фибробластической капсулы вокруг камеры
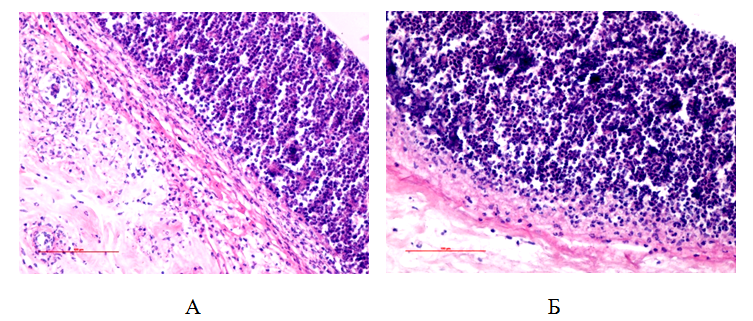
Рис.9. Лейкоцитарный вал и формирующаяся фибробластическая капсула вокруг стенки камеры у контрольных (А) и опытных (Б) животных. 3 сутки от начала воспаления
В отдаленной зоне часть микрососудов запустевает, регистрируется небольшое количество моноцитов и лимфоцитов, плотность которых составляет 6,4 ± 1,8 на 1000 мкм2. Наблюдается миграция в очаг воспаления малодифференцированных фибробластов, плотность которых на этот срок составляет 3,3 ± 0,6 на 1000 мкм2 (рис 10).
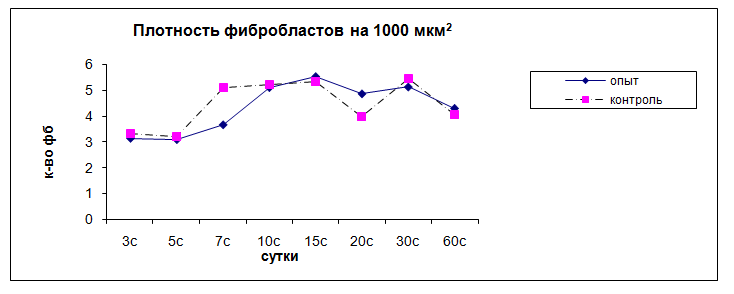
Рис. 10. Динамика плотности фибробластов в очаге воспаления
Через 5 суток после начала воспалительного процесса толщина лейкоцитарного вала с плотностью клеток 23,1 ± 2,8 на 1000 мкм2 снижается и составляет 100,1 ± 14 мкм. В вале соотношение мононуклеар : нейтрофил = 9 : 1. Макрофаги активно фагоцитируют нейтрофильный детрит. Вокруг лейкоцитарного вала формируется фибробластическая капсула, состоящая из 3-4 слоев параллельно ориентированных фибробластов, толщиной 46,1 ± 3,2 мкм. Между фибробластами находятся макрофаги, имеются слабые признаки синтеза коллагена. Периферическая зона очага воспаления соответствует предыдущему сроку (рис. 11).
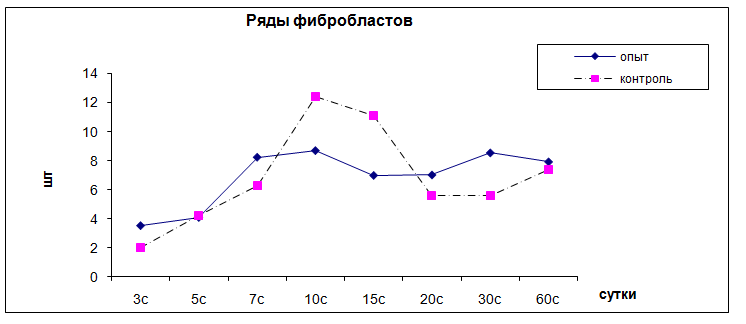
Рис. 11. Динамика рядов фибробластов вокруг камеры
Через 7 суток после введения камер к их стенке прилежит клеточный инфильтрат, толщина которого составляет 107,2 ± 19 мкм, плотность клеток 22,2 ± 5,2 на 1000 мкм2. Наблюдается обновление состава инфильтрата за счет нейтрофилов, соотношение нейтрофил : макрофаг = 1 : 1. Толщина фибробластической капсулы вокруг вала составляет 68,9 ± 7,2 мкм, число параллельно ориентированных слоев фибробластов составляет 6,3 ± 1,2, имеется незначительное количество вновь синтезированного коллагена.
В отдаленной зоне количество расширенных микрососудов увеличивается по сравнению с предыдущим сроком, плотность лейкоцитов составляет 4,5 ± 1,2 на 1000 мкм2, плотность малодифференцированных фибробластов – 5,1 ± 0,8 на 1000 мкм2.
На 10 сутки от начала воспаления толщина лейкоцитарного вала вокруг камеры увеличивается и составляет 227,2 ± 16 мкм, качественный состав инфильтрата соответствует предыдущему сроку. Фибробластическая капсула вокруг лейкоцитарного вала толщиной 100,1 ± 18,2 мкм, состоит из 12,4 ± 1,6 числа слоев фибробластов. Она незначительно уплотняется по сравнению с предыдущим сроком, хотя остается рыхлой. Количество коллагена не соответствует числу фибробластов, между нитями коллагена продолжают сохраняться лейкоциты и макрофаги. Морфологическая картина отдаленной зоны по сравнению с предыдущим сроком не изменилась.
Через 15 суток от начала воспаления состояние клеточного вала вокруг камер практически не изменилось. Показатели фагоцитоза лейкоцитов составили: ФЧ = 6,1 ± 1,1 микробных тел; ФИ = 72 ± 4%. Фибробластическая капсула сохранила прежнюю толщину, число слоев фибробластов – 11,1 ± 3,2, нити коллагена лежат рыхло.
В отдаленной зоне продолжает регистрироваться незначительное полнокровие сосудов, плотность лейкоцитов – 3,1 ± 0,7 на 1000 мкм2, плотность малодифференцированных фибробластов - 5,3 ± 0,7 на 1000 мкм2.
Через 20 суток после введения камер вокруг них наблюдается следующая картина: сохраняется клеточный инфильтрат толщиной 167,5 ± 46,18 мкм с плотностью клеток 11,62 ± 0,51 на 1000 мкм2, соотношение нейтрофил : мононуклеар = 1 : 3. Макрофаги активно фагоцитируют аутолизированные нейтрофилы. Вокруг клеточного вала сформировалась рыхлая фибробластическая капсула толщиной 252,08 ± 46,21 мкм, число слоев фибробластов – 5,6 ± 0,74. Фибробласты недостаточно интенсивно синтезируют коллаген, часть его фагоцитируется макрофагами. В периферической зоне очага воспаления увеличивается плотность фибробластов – 2,2 ± 0,45 на 1000 мкм2, и уменьшается плотность лейкоцитов.
Через 30-60 суток после начала воспаления в очаге вокруг камер наблюдается следующая картина: толщина лейкоцитарного вала значительно снижается до 112,18 ± 22,22 мкм, в нем преобладают макрофаги, соотношение нейтрофил : макрофаг = 1 : 9. Толщина фибробластической капсулы увеличивается до 365,34 ± 54,71 мкм, число слоев фибробластов 6,48 ± 0,96, продолжается синтез коллагена. Соединительная ткань капсулы созревает, уплотняется, в ней значительно уменьшается содержание лейкоцитов (рис. 12). Периферическая зона очага воспаления соответствует норме.
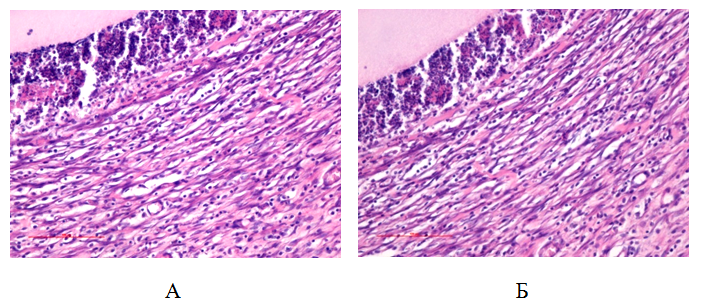
Рис.12. Фибробластическая капсула вокруг стенки камеры у контрольных (А) и опытных (Б) животных. 60 сутки от начала воспаления
Динамика воспалительного процесса у опытных животных
Через 48ч после начала воспаления вокруг стенки камер наблюдается клеточный вал толщиной 313,18 ± 30,19 мкм с плотностью лейкоцитов 23,76 ± 2,22 на 1000 мкм2 . Соотношение нейтрофил : макрофаг = 2 : 1. Лейкоциты активно фагоцитируют стафилококк, фагоцитарное число (ФЧ) = 3,97 ± 0,7 микробных тел, фагоцитарный индекс (ФИ) = 60 ± 7,07%.
В отдаленной зоне на этот срок концентрация лейкоцитов составляет на 10,7 ± 2,6 на 1000 мкм2, соотношение нейтрофил : мононуклеар = 1 : 1, появляются отдельные малодифференцированные фибробласты. Большинство микрососудов полнокровно и расширено.
Через 3 суток после введения камер толщина лейкоцитарного вала сохраняется и составляет 334,38 ± 25,69 мкм, плотность клеток 21,34 ± 1,88 на 1000 мкм2, соотношение нейтрофил : макрофаг = 1 : 1. Лейкоциты интенсивно захватывают стафилококк, наблюдаются фигуры незавершенного фагоцитоза, происходит массовая гибель нейтрофилов в вале. По периферии лейкоцитарного инфильтрата появляются 3-4 слоя параллельно ориентированных фибробластов.
В периферической зоне очага воспаления микрососуды остаются расширенными, регистрируется небольшое количество дегранулированных тучных клеток и эозинофилов. Плотность мононуклеаров и нейтрофилов на 9,4 ± 1,8 на 1000 мкм2. Повышается концентрация малодифференцированных фибробластов, которая составляет 3,15 ± 0,78 на 1000 мкм2.
Через 5 суток после начала воспаления толщина лейкоцитарного вала резко уменьшается по сравнению с предыдущим сроком и составляет 157,86 ± 46,08 мкм. Большинство нейтрофилов находятся в стадии аутолиза и дегрануляции, макрофаги активно фагоцитируют нейтрофильный детрит. Соотношение нейтрофил: макрофаг = 1:3. Вокруг лейкоцитарного вала формируется фибробластическая капсула толщиной 170,5 ± 52,11 мкм, число слоев фибробластов 4,08 ± 1,59, признаков синтеза коллагена не наблюдается.
В отдаленной зоне состояние микрососудов соответствует предыдущему сроку. Наблюдается миграция в очаг воспаления лейкоцитов, плотность которых равна 7,9 ± 2,2 на 1000 мкм2, соотношение нейтрофил : мононуклеар = 1 : 1, увеличивается концентрация малодифференцированных фибробластов до 5,5 ± 0,9 на 1000 мкм2.
Через 7 суток после введения камер толщина клеточного вала увеличивается до 220 ± 29,67 мкм, плотность лейкоцитов в вале 17,92 ± 1,82 на 1000 мкм2, соотношение нейтрофил: макрофаг = 1 : 3, продолжается фагоцитоз аутолизированных нейтрофилов и стафилококка. Увеличивается толщина фибробластической капсулы до 314,17 ± 44,88 мкм, число слоев фибробластов составляет 8,25 ± 0,54. Фибробласты слабо ориентированы в параллельные ряды, между ними регистрируется небольшое количество вновь синтезированного коллагена, имеются макрофаги, лимфоциты и нейтрофилы. Состояние отдаленной зоны соответствует предыдущему сроку, однако, увеличивается концентрация малодифференцированных фибробластов до 7,2 ± 2 на 1000 мкм2.
На 10 сутки от начала воспаления происходит уменьшение толщины вала до 129,52 ± 21,01 мкм, плотность клеток в вале составляет 15,3 ± 1,15 на 1000 мкм2, преобладают макрофаги, которые активно фагоцитируют. Соотношение нейтрофил : макрофаг = 1 : 5. Соединительнотканная капсула вокруг вала уплотняется, толщина ее равна 321,57 ± 39,72 мкм, число слоев фибробластов 8,71 ± 2,41. Увеличивается синтез коллагена, хотя его количества недостаточно для надежной изоляции очага воспаления от здоровых тканей. Состояние периферической зоны очага воспаления, по сравнению с предыдущим сроком, не изменилось.
На 15 сутки воспаления толщина и состояние лейкоцитарного вала не меняются. Состояние фагоцитоза соответствует следующим показателям: ФЧ = 2,82 ± 0,42 микробных тел, ФИ = 19 ± 1%. Продолжается созревание фибробластической капсулы, толщина ее равна 284,35 ± 49,06 мкм, число слоев фибробластов 6,99 ± 1,57. Увеличивается количество фибрилл коллагена.
В отдаленной зоне регистрируется незначительное увеличение диаметра микрососудов, имеется небольшое число малодифференцированных фибробластов, концентрация которых составляет на 5,1 ± 0,7 на 1000 мкм2.
На 20-30-60 сутки с момента имплантации камер вокруг них наблюдается следующая картина: непосредственно вокруг стенок камер сохраняются остатки лейкоцитарного вала толщиной 117,86 ± 29,6 мкм, плотность лейкоцитов составляет 12,01 ± 1,89 на 1000 мкм2. В инфильтрате преобладают макрофаги, соотношение нейтрофил : макрофаг = 1 : 9. Вокруг лейкоцитарного вала образуется фибробластическая капсула толщиной 334,07 ± 100,4 мкм, число слоев фибробластов 7,83 ± 2,3. Фибробласты интенсивно синтезируют коллаген, однако, между пучками коллагена наблюдаются макрофаги, капсула остается рыхлой. Отдаленная зона очага воспаления практически соответствует норме, хотя часть микрососудов полнокровна и расширена. Около сосудов имеются единичные малодифференцированные фибробласты.
Заключение
Через 48 ч от начала воспаления у контрольных животных происходит миграция лейкоцитов из микрососудов в очаг повреждения, они накапливаются вокруг стенки камеры. Толщина лейкоцитарного вала через 2 суток составляет 118,2 ± 18 мкм, через 3 суток достигает максимума – 241,2 ± 16 мкм. Под влиянием препарата Омник процесс миграции лейкоцитов усиливается, через 2 суток толщина лейкоцитарного вала составляет 313,18 ± 30,19 мкм, через 3 суток – 334,38 ± 25,69 мкм. Затем происходят закономерные колебания толщины лейкоцитарного вала, достоверных отличий между контролем и опытом не наблюдается.
Интенсивность фагоцитоза по показателям фагоцитарного числа и фагоцитарного индекса у животных, получавших препарат Омник, не имеет достоверных различий по сравнению с контрольными.
Начиная с 3 – 5 суток от начала воспаления, у контрольных животных вокруг лейкоцитарного вала формируется фибробластическая капсула, толщина которой постепенно увеличивается и к 30 суткам достигает 279,17 ± 35,56 мкм, число слоев фибробластов в ней 5,6 ± 0,87. У животных, получавших препарат Омник, толщина фибробластической капсулы на протяжении всего эксперимента достоверно выше, чем в контроле. К 30 суткам она составляет 340,83 ± 137, 31 мкм, число слоев фибробластов в ней 8,545 ± 2,54.
Влияние препарата Омник на динамику клеточных реакций в очаге воспаления заключается в следующем:
- Усиливаются миграционные способности лейкоцитов. Они быстрее, чем в контроле, накапливаются в очаге воспаления, однако, фагоцитарная реакция клеток под влиянием препарата Омник не изменяется.
- Фибробласты интенсивно концентрируются вокруг лейкоцитарного вала, скорость образования фибробластической капсулы увеличивается. При этом синтез фибробластами коллагена не соответствует толщине соединительнотканной капсулы, что нарушает процесс созревания капсулы.
По нашему мнению, точкой приложения действия препарата Омник является стенка микрососудов в очаге воспаления, которая становится более проницаемой для клеток на ранних стадиях процесса. Предположительно, механизм этого феномена может быть связан с влиянием препарата на тонус капилляров и венул. Данные литературы косвенно подтверждают наше мнение, т.к. известно, что альфа-адреноблокаторы могут вызывать расширение микрососудов кожи, увеличение межэндотелиальных щелей и другие реакции, приводящие к более интенсивной миграции лейкоцитов в зону воспаления [10-15].
Список литературы
1. Пушкарь Д.Ю., Лоран О.Б., Раснер П.И. Терапия альфа-адреноблокаторами – метод выбора в лечении обструктивного мочеиспускания у мужчин и женщин. Урол. и андрол. 2002; 10 (61).
2. Мазо Е.Б., Белковская М.Н. Фармакотерапия доброкачественной гиперплазии простаты. Рус. мед. журн. 2001; 9 (16–17).
3. Регистр лекарственных средств: http://www.rlsnet.ru/registration.html.
4. Данилов В.В., Елисеева Е.В., Данилов В.В. / К вопросу механизма действия альфа1-адреноблокаторов // РМЖ., 2010 № 2. Т. 17. С. 109-113.
5. Kortmann BBM, Floratos DL, Kiemeney LA et al. Urodynamic effects of alpha-adrenoceptor blockers: a review of clinical trials. Urology 2003 Jul;62(1):1–9 (Level 4). http://www.ncbi.nlm.nih.gov/pubmed/12837408
6. Hu ZW, Shi XY, Hoffman BB. Doxazosin inhibits proliferation and migration of human vascular smooth-muscle cells independent of alpha1-adrenergic receptor antagonism. J Cardiovasc Pharmacol. 1998 Jun;31(6):833-9. doi: 10.1097/00005344-199806000-00006. PMID: 9641467.
7. Johnson R, Webb JG, Newman WH, Wang Z. Regulation of human vascular smooth muscle cell migration by beta-adrenergic receptors. Am Surg. 2006 Jan;72(1):51-4. PMID: 16494183.
8. Xiao Q, Liu QM, Jiang RC, Chen KF, Zhu X, Ma L, Li WX, He F, Huang JJ. Piperazine-Derived α1D/1A Antagonist 1- Benzyl-N- (3-(4- (2-Methoxyphenyl) Piperazine-1-yl) Propyl) -1H- Indole-2- Carboxamide Induces Apoptosis in Benign Prostatic Hyperplasia Independently of α1-Adrenoceptor Blocking. Front Pharmacol. 2021 Jan 27;11:594038. doi: 10.3389/fphar.2020.594038. PMID: 33584271; PMCID: PMC7873900.
9. Martin FM, Harris AM, Rowland RG, Conner W, Lane M, Durbin E, Baron AT, Kyprianou N. Decreased risk of bladder cancer in men treated with quinazoline-based α1-adrenoceptor antagonists. Gene Ther Mol Biol. 2008;12(2):253-258. PMID: 20717483; PMCID: PMC2921713.
10. Yang X, Thomas DP, Zhang X, Culver BW, Alexander BM, Murdoch WJ, Rao MN, Tulis DA, Ren J, Sreejayan N. Curcumin inhibits platelet-derived growth factor-stimulated vascular smooth muscle cell function and injury-induced neointima formation. Arterioscler Thromb Vasc Biol. 2006 Jan;26(1):85-90. doi: 10.1161/01.ATV.0000191635.00744.b6. Epub 2005 Oct 20. PMID: 16239599.
11. Pukac L, Huangpu J, Karnovsky MJ. Platelet-derived growth factor-BB, insulin-like growth factor-I, and phorbol ester activate different signaling pathways for stimulation of vascular smooth muscle cell migration. Exp Cell Res. 1998 Aug 1;242(2):548-60. doi: 10.1006/excr.1998.4138. PMID: 9683541.
12. Boesch ST, Corvin S, Zhang J, Rogatsch H, Bartsch G, Klocker H. Modulation of the differentiation status of cultured prostatic smooth muscle cells by an alpha1-adrenergic receptor antagonist. Prostate. 1999 Jun 1;39(4):226-33. doi: 10.1002/(sici)1097-0045(19990601)39:4<226::aid-pros2>3.0.co;2-8. PMID: 10344211.
13. Liu QM, Xiao Q, Zhu X, Chen KF, Liu XW, Jiang RC, Wu D, Shi JM, Dai LJ, Huang JJ. Inhibitory effect of α1D/1A antagonist 2-(1H-indol-3-yl)-N-[3-(4-(2-methoxyphenyl) piperazinyl) propyl] acetamide on estrogen/androgen-induced rat benign prostatic hyperplasia model in vivo. Eur J Pharmacol. 2020 Mar 5;870:172817. doi: 10.1016/j.ejphar.2019.172817. Epub 2019 Nov 19. PMID: 31756334.
14. Kappert K, Sparwel J, Sandin A, Seiler A, Siebolts U, Leppänen O, Rosenkranz S, Ostman A. Antioxidants relieve phosphatase inhibition and reduce PDGF signaling in cultured VSMCs and in restenosis. Arterioscler Thromb Vasc Biol. 2006 Dec;26(12):2644-51. doi: 10.1161/01.ATV.0000246777.30819.85. Epub 2006 Sep 21. PMID: 16990553.
15. Kappert K, Paulsson J, Sparwel J, Leppänen O, Hellberg C, Ostman A, Micke P. Dynamic changes in the expression of DEP-1 and other PDGF receptor-antagonizing PTPs during onset and termination of neointima formation. FASEB J. 2007 Feb;21(2):523-34. doi: 10.1096/fj.06-6219com. Epub 2006 Dec 8. PMID: 17158785.
Об авторах
Игорь Жанович СеминскийРоссия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики
Светлана Николаевна Серебренникова
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Елена Анатольевна Ткачук
Россия
д.м.н., доцент, профессор кафедры генетики ФГБОУ ВО ИГМУ Минздрава России, Россия, 664003, г. Иркутск, ул. Красного Восстания, 1; старший научный сотрудник ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека», Россия, 664003, г. Иркутск, ул. Тимирязева, 16; ведущий научный сотрудник ФГБНУ «Восточно-Сибирский институт медико-экологических исследований», Россия, 665826, г. Ангарск, микрорайон 12а, дом 3
Юрий Васильевич Васильев
Россия
д.м.н., профессор
Рецензия
Для цитирования:
Семинский И.Ж., Серебренникова С.Н., Ткачук Е.А., Васильев Ю.В. ВЛИЯНИЕ ПРЕПАРАТА ОМНИК НА ИНТЕНСИВНОСТЬ КЛЕТОЧНЫХ РЕАКЦИЙ В ОЧАГЕ ЭКСПЕРИМЕНТАЛЬНОГО ВОСПАЛЕНИЯ. Байкальский медицинский журнал. 2024;3(4):40-49. https://doi.org/10.57256/2949-0715-2024-4-40-49
For citation:
Seminsky I.Zh., Serebrennikova S.N., Tkachuk E.A., Vasiliev Yu.V. INFLUENCE OF THE DRUG OMNIC ON THE INTENSITY OF CELLULAR REACTIONS IN THE SPOTS OF EXPERIMENTAL INFLAMMATION. Baikal Medical Journal. 2024;3(4):40-49. (In Russ.) https://doi.org/10.57256/2949-0715-2024-4-40-49
JATS XML
















