Перейти к:
ВЛИЯНИЕ ТКАНЕВЫХ АНГИОТЕНЗИНОВ НА ЭЛЕМЕНТЫ КАРДИОВАСКУЛЯРНОЙ СИСТЕМЫ (ЛЕКЦИЯ 2)
https://doi.org/10.57256/2949-0715-2024-3-71-82
Аннотация
Актуальность. Одной из основных причин смертности по данным Всемирной организации здравоохранения являются кардиоваскулярные заболевания. Хорошо известно, что нарушение регуляции и/или сверхэкспрессия элементов ренин-ангиотензиновой системы приводит к множеству негативных сосудистых эффектов, способствуя тем самым развитию сердечно-сосудистых заболеваний и патологических процессов, включая артериальную гипертензию, аневризмы, застойную сердечную недостаточность, инсульт, ишемическую болезнь сердца и дисфункцию эндотелия.
Цель. Рассмотреть основные ангиотензины и механизмы их действия на тонус сосудов, функционирование эндотелия, работу миокарда. Продемонстрировать участие ренин-ангиотензиновой системы в формировании основных видов патологии сердечно-сосудистой системы
Результаты. В лекции рассмотрены кардиогенные и сосудистые эффекты ангиотензинов II, 1–7, 1–9 и роль этих ангиотензинов в развитии атеросклероза, ишемической болезни сердца, сердечной недостаточности, артериальной гипертензии. Приводятся основные принципы коррекции нарушения системы ангиотензинов и перспективные направления исследования этой проблемы.
Заключение. Представление о классической ренин-ангиотензиновой системе, регулирующий артериальное давление и тонус сосудов, превратилось в понимание видения этой системы, как сложной сети медиаторов-антиотензинов и их рецепторов, влияющих на множество физиологических путей.
Хотя основные компоненты ренин-ангиотензиновой ситемы были открыты более полувека назад, эта система до сих пор привлекает большое количество исследовательских работ в различных областях. Ренин-ангиотензин-альдостероновая система обладает рядом регуляторных и контррегуляторных осей, оказывающих значимое влияние на течение многих заболеваний. Среди многочисленных вариантов сердечно-сосудистой терапии, используемых для лечения гипертонии и сердечной недостаточности, существенную терапевтическую роль играют препараты, влияющие на ренин-ангиотензин-альдостероновую систему.
Ключевые слова
Для цитирования:
Гуцол Л.О., Егорова И.Э. ВЛИЯНИЕ ТКАНЕВЫХ АНГИОТЕНЗИНОВ НА ЭЛЕМЕНТЫ КАРДИОВАСКУЛЯРНОЙ СИСТЕМЫ (ЛЕКЦИЯ 2). Байкальский медицинский журнал. 2024;3(3):71-82. https://doi.org/10.57256/2949-0715-2024-3-71-82
For citation:
Gutsol L.O., Egorova I.E. THE INFLUENCE OF TISSUE ANGIOTENSINS ON ELEMENTS OF THE CARDIOVASCULAR SYSTEM (LECTURE 2). Baikal Medical Journal. 2024;3(3):71-82. (In Russ.) https://doi.org/10.57256/2949-0715-2024-3-71-82
Элементы миокардиальной ренин-ангиотензиновой системы
На работу миокарда одновременно оказывают влияние как системная ренин-ангиотензин-альдостероновая система (РААС), так и тканевая ренин-ангиотензиновая система (РАС) [1, 2].
Один из наиболее значимых и изученных эффекторов сердечной РАС – ангиотензин II (АТ II) – образуется под влиянием двух ферментов: ангиотензинпревращающего фермента (АПФ) и химазы (рис. 1), которые синтезируются в различных типах клеток, включая тучные клетки, сердечные фибробласты и эндотелиальные клетки сосудов. Химаза обнаружена в интерстициальном пространстве сердца и кровеносных сосудов и является элементом тканевой РАС, тогда как АПФ находится главным образом в кровотоке [3]. Предполагают, что 90 % АТ I и 75 % АТ II в сердце являются элементами тканевой РАС, а 10 % и 25 %, соответственно, являются производными ренина плазмы [3].
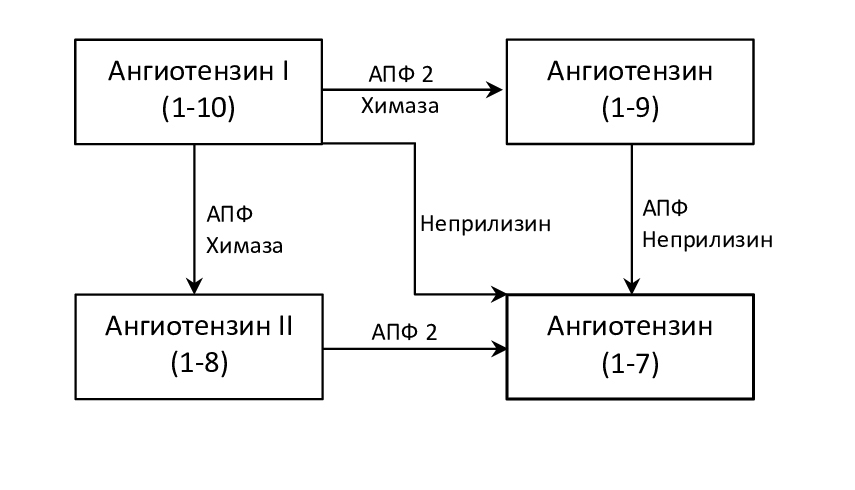
Рис. 1. Пути образования АТ II и его основных антагонистов
Таким образом, две системы, по-видимому, действуют независимо. Показано, например, что изменения системного и тканевого ангиотензина при прогрессировании сердечной недостаточности (СН) не совпадают: концентрация АТ II в сердце примерно в 100 раз выше, чем в плазме[4].
Как показали экспериментальные данные, с возрастом большее значение в синтезе АТ II приобретает химаза, субстратами которой являются как АТ I, так и АТ (1–12) [5].
В сердце экспрессируются оба основных типа рецепторов (R) АТ II: AT1-R и AT2-R. Рецепторы АТ1 и АТ2 всегда присутствуют на кардиомиоцитах, а присутствие этих рецепторов на фибробластах зависит от наличия или отсутствия заболеваний сердца: в физиологических условиях на фибробластах имеются только АТ1-R, но при патологии сердца они могут экспрессировать также и АТ2-R [3].
Кардиогенные эффекты АТ II
Через эти рецепторы АТ II реализует свои основные эффекты в миокарде: активация/торможение синтеза медиаторов воспаления, усиление/уменьшение ударного объема сердца, гипертрофию, ремоделирование и апоптоз (рис. 2)
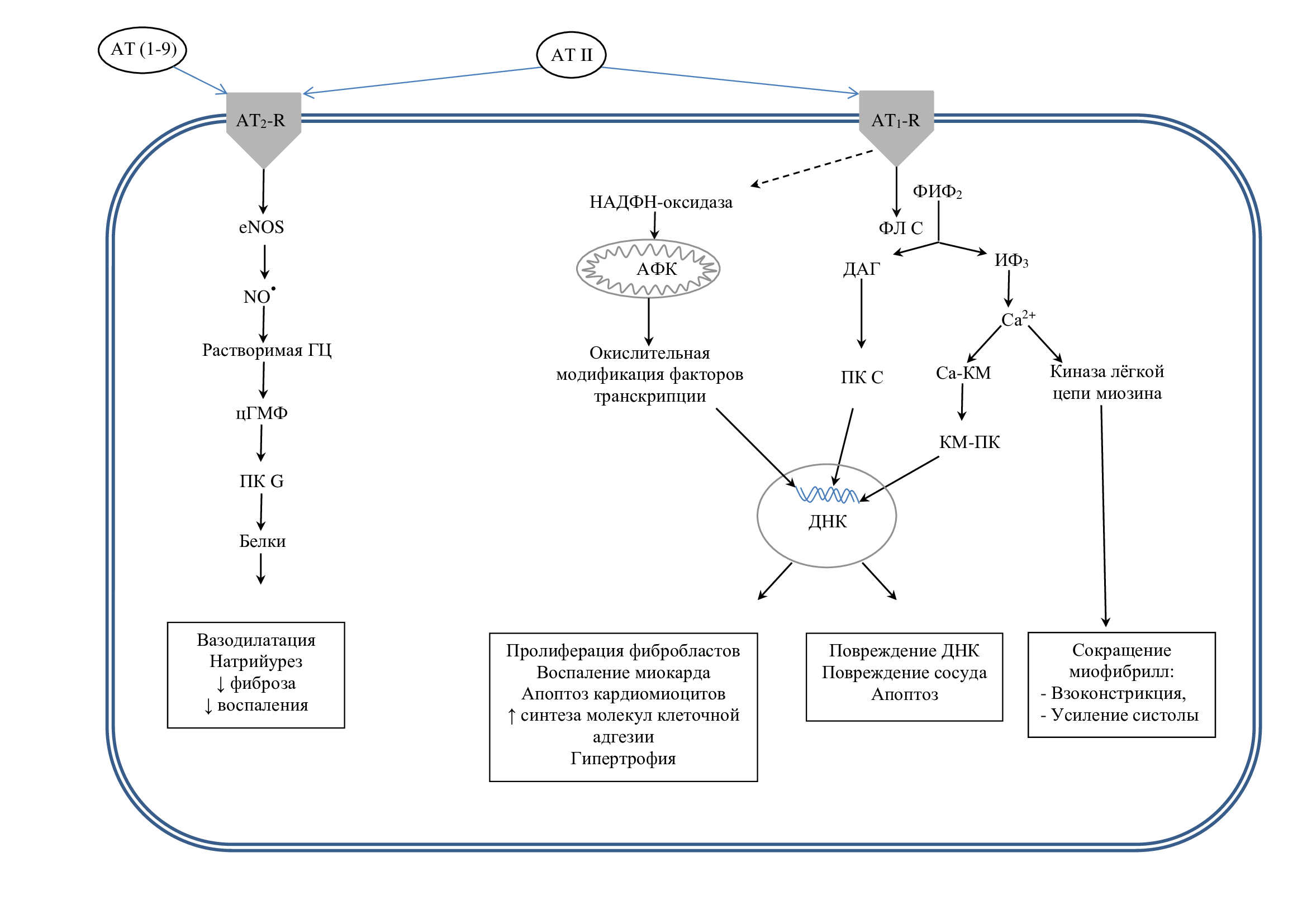
Рис. 2. Эффекты ангиотензинов через АТ1-R и AT2-R
ГЦ – гуанилилциклаза; цГМФ – циклический гуанозинмонофосфат; ПК G –протеинкиназа G; ФИФ2 – фосфатидилинозитолбисфосфат; ФЛ С– фосфолипаза С, ДАГ –диацилглицерид; ИФ3 – инозитол-3-фосфат; ПК С – протеинкиназа С; Са2+-КМ – комплекс Са2+-кальмодулин; КМ-ПК – кальмодулинзависимая протеинкиназа.
Воспаление. Активация AT1-R увеличивает образование в кардиомиоцитах активных форм кислорода, фактора некроза опухолей β (ФНО-β) и других медиаторов воспаления. Активация AT2-R вызывает противоположные эффекты [3].
Инотропные эффекты. В «сверхфизиологических» концентрациях АТ II увеличивает силу сердечных сокращений, стимулируя вхождение кальция в клетку непосредственно или опосредовано через симпатическую нервную систему. Увеличение кальция в кардиомиоцитах приводит к нарушению процесса расслабления полостей сердца и нарушению стадии диастолы. Исследования на крысах с экспериментальной гипертрофией левого желудочка подтвердили, что локально генерируемый АТ II может нарушать расслабление кардиомиоцитов [3].
Гипертрофия. Через АТ1-R АТ II опосредует гипертрофию миоцитов в ответ на повышенную нагрузку миокарда. Исследования на модели культуры клеток крысы показали, что этот эффект реализуется трансформирующим фактором роста β и эндотелином-1, синтезируемыми сердечными фибробластами. Исследования на трансгенных мышах TG1306/1R показали развитие гипертрофии миокарда под влиянием АТ II в отсутствие повышенного артериального давления, что подтверждает участие в этом процессе локальной РАС. Роль АТ2-R в гипертрофии сердца до конца не изучена [3].
Фиброз. РАС оказывает значительное влияние на ремоделирование микарда после перенесенного инфаркта миокарда (ИМ), в т. ч. за счет участия в фиброзировании. Важную роль в этом процессе играет увеличение образования АПФ сердца. Активность АПФ плазмы при этом не изменяется [3].
- Y. Sun, K. T. Weber [6] в экспериментах на сердцах крыс показали, что на 1-й и 4-й неделе после ИМ АТI-R экспрессируются преимущественно миофибробластами, в то время как фибробласты, макрофаги и сосуды меньше экспрессируют этих рецепторов. При введении лазартана (антагониста АТI-R) синтез коллагена в периферических участках инфаркта снижается.
Апоптоз. Апоптоз кардиомиоцитов активируется через АТ1-R. Этот процесс участвует в ремоделировании сердца после ИМ и при артериальной гипертензии. Апоптоз эффективно блокируется антагонистами AT1-R [3].
Кардиогенные эффекты АТ (1–9) и АТ (1–7)
Деградация АТ I и АТ II ферментом АПФ 2 приводит к образованию их антагонистов: АТ (1–9) и АТ (1–7). Поскольку АПФ 2 играет решающую роль в образовании этих ангиотензинов-антагонистов в последние годы много исследований посвящено изучению этого фермента и его кардиопротекторному влиянию на миокард [7].
У человека AПФ 2 экспрессируется в кардиомиоцитах предсердий и желудочков, гладкомышечных и эндотелиальных клетках сосудов и фибробластах. Потеря АПФ 2 способствует ремоделированию желудочков после ИМ за счет усиления эффектов АТ II реализуемых через AT1-R.
Было показано, что АПФ 2 имеет решающее значение для функционирования сердца, расширения сосудов и баланса жидкости. У мышей с мутацией АПФ 2-/y наблюдаются нарушения сократимости, повышенная экспрессия маркеров гипоксии и повышенные уровни циркулирующего АТ II по сравнению с контрольными мышами. Кроме того, у мутантных мышей АПФ 2-/y развивается АТ II-опосредованная дилатационная кардиомиопатия, которая характеризуется увеличением маркеров окислительного стресса и воспаления, патологической гипертрофией и нарушением функции левого желудочка [8].
Активность АПФ 2 регулируется сердечными шеддазами: при их активации увеличивается секреция растворимой формы АПФ 2 в кровоток и снижается активность этого фермента на мембранах клеток миокарда (рис. 3). Повышенная потеря АПФ 2 с поверхности клетки приводит к уменьшению превращения АТ II в АТ (1–7) и накоплению АТ II. Уровни растворимой формы АПФ 2 в плазме повышаются у пациентов с СН со сниженной фракцией выброса, поэтому циркулирующая растворимая форма АПФ 2 была признана одним из маркеров неблагоприятного прогноза при сердечной недостаточности (СН) [9].
АПФ 2 реализует свои эффекты через АТ (1–7), который образуется в сердце тремя путями: из AТ II, AТ I непосредственно или через промежуточный продукт АТ (1–9) (рис. 1). На сегодняшний день на кардиомиоцитах обнаружены два типа рецепторов, лигандами которых является АТ (1–7) – MasR и MrgD. При этом, основные эффекты АТ (1–7) реализуются через MasR, а через MrgD действует его метаболит — аламандин [8].
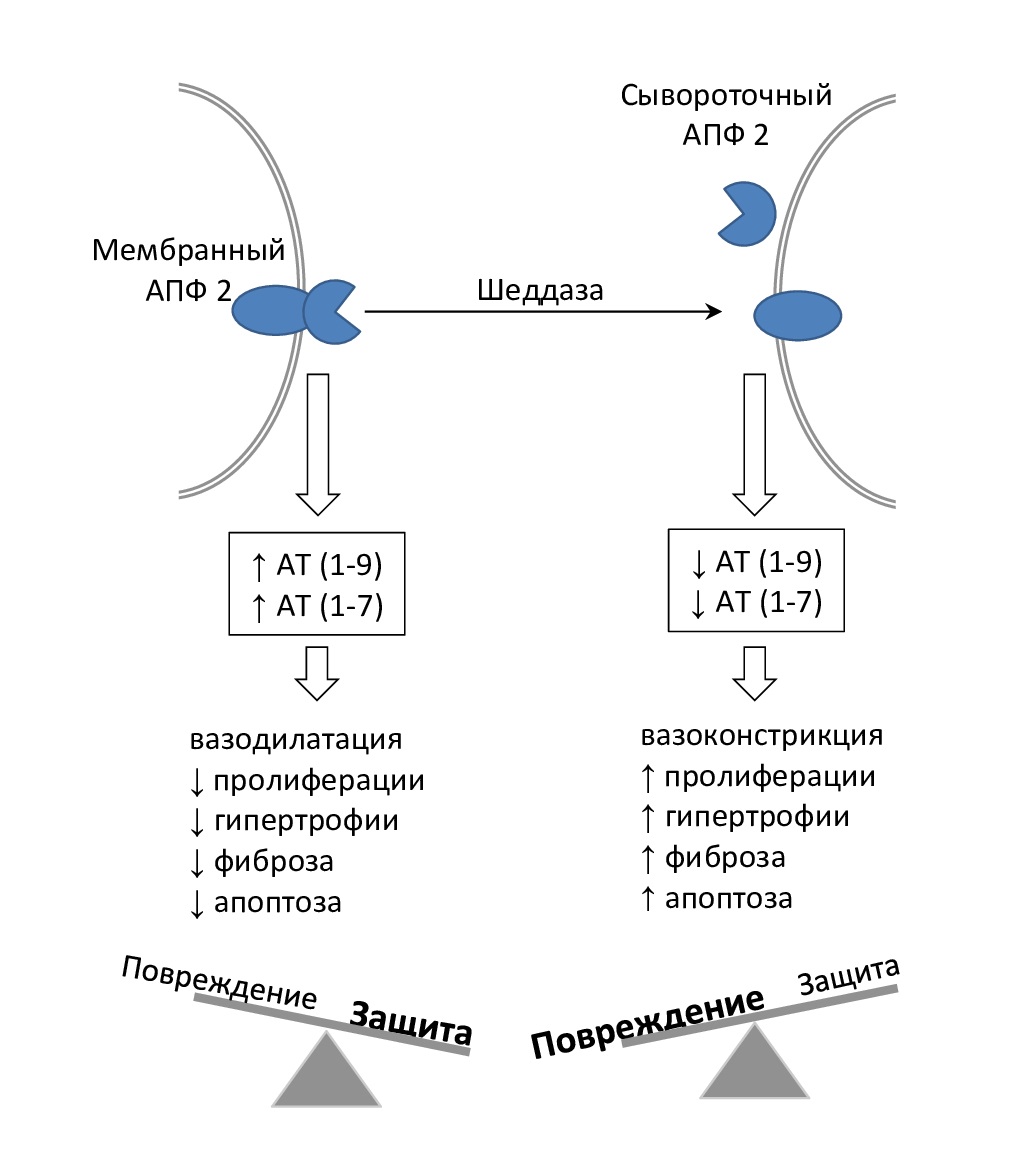
Рис. 3. Роль шеддаз в активации АПФ 2, защите и повреждении сосудистой стенки
Воздействуя на эти рецепторы АТ (1–7) проявляет кардиопротекторные эффекты: антигипертензивные, антипролиферативные, антифиброзные, антиаритмические и противовоспалительные (рис. 3).
Другой метаболит ангиотензинов – АТ (1–9) может соединяться с AT2-R и активировать кардиопротекторные эффекты этого рецептора (рис. 2) [8].
Таким образом, ось АПФ/АТ II/AT1-R и группа осей – АПФ/АТ II/AT2-R, АПФ 2/АТ (1–7)/MasR, АПФ 2/АТ (1–9)/АТ2-R являются физиологическими антагонистами, уравновешивающими друг друга при формировании эффектов РАС на миокард.
Равновесию эффектов этих осей способствует активность АПФ 2. Снижение активности АПФ 2 приводит к активации оси АТ II/AT1-R и способствует ускорению прогрессирования заболеваний сердца. Повышенная активность АПФ 2 приводит к преобладанию защитных эффектов осей АПФ 2/АТ (1–9) и АПФ 2/ АТ (1–7) и, соответственно, к защите сердца (рис. 4) [9].
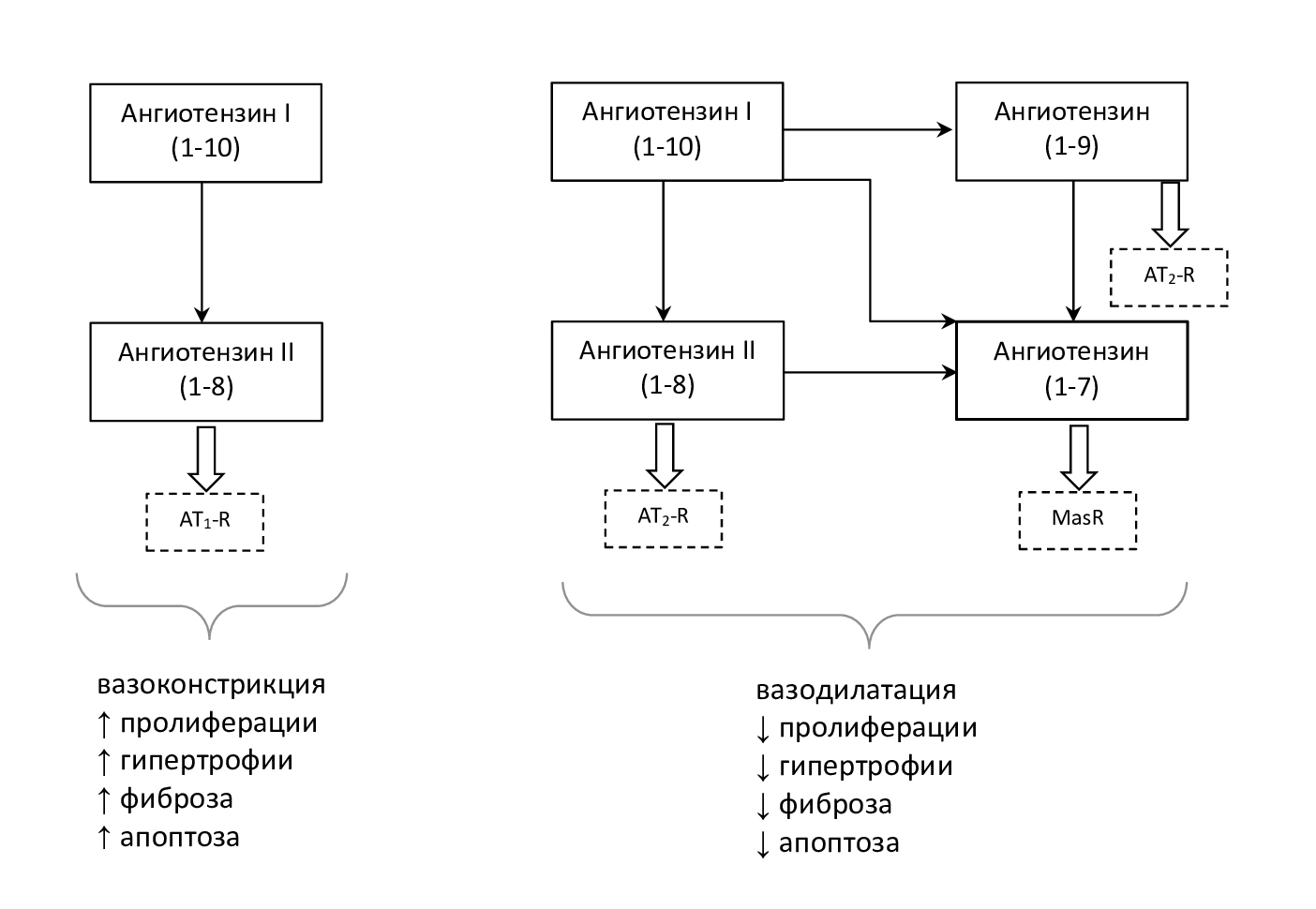
Рис. 4. Основные эффекты производных ангиотензина I
Потенциальное влияние на миокард других ангиотензинов – компонентов РАС изучается.
В совокупности эти данные позволяют предположить, что кардиопротекторные эффекты АТ (1–7) и АТ (1–9) могут быть использованы в качестве фармакологических средств при лечении заболеваний миокарда.
Элементы сосудистой РАС
Элементы РАС обнаруживаются не только в клетках миокарда, но и клетках сосудистой стенки и в различных слоях распределяются неравномерно.
Предшественник ангиотензинов – ангиотензиноген секретируется преимущественно адипоцитами адвентиции сосудов и затем диффундирует через сосудистую стенку в кровоток, где и взаимодействует с плазменным ренином. В сосудистой стенке обнаруживаются оба типа ангиотензинпревращающего фермента: АПФ располагается на эндотелиоцитах, а АПФ 2 – не только на эндотелиоцитах, но и на гладкомышечных клетках сосудов, что свидетельствует о том, что в сосудистой стенке могут образовываться два основных компонента локальной РАС – АТ II и АТ (1–7). Разделить эффекты производного ангиотензиногена – АТ II, генерируемым в плазме, и эффекты, локального АТ II, генерируемым внутри сосудистой стенки в исследованиях in vivo невозможно. Поэтому локальный синтез АТ II в сосудах был доказан в эксперименте на изолированных перфузируемых задних конечностях крыс [10]. Авторы исследования показали, что примерно 50 % АТ I может быть преобразовано в АТ II при однократном протекании крови через заднюю конечность. При введении ингибиторов АПФ образование АТ II прекращается. Эти данные подтверждают синтез АТ II локальной сосудистой РАС [3, 11].
Известно, что в эндотелиальных клетках экспрессируются как AT1-R, так и AT2-R. В гладкомышечных клетках сосудов и адвентиции в основном экспрессируются AT1-R, причем в адвентиции они образуются в небольшом количестве [11].
На эндотелиоцитах также обнаружены рецепторы Mas и MrgD и это позволяет предположить, что основные лиганды этих рецепторов – АТ (1–7) и аламандин играют важную роль в физиологии кровеносных сосудов [12].
АТ (1–7) уменьшает апоптоз и пролиферацию, индуцированные АТ II. Кроме того, АТ (1–7) тормозит новообразование сосудов за счет уменьшения синтеза гормонов, стимулирующих этот процесс, таких как фактор роста эндотелия сосудов А [3].
Введение АТ (1–7) в аорту крыс предотвращает стимулируемую АТ II выработку активных форм кислорода (АФК) и, таким образом, снижает развитие в эндотелиоцитах окислительного стресса, а также увеличивает высвобождение монооксида азота (NO•), что приводит к усилению вазодилатации.
Синтез и высвобождение NO• также стимулирует аламандин, активируя в эндотелиальных клетках через рецептор MrgD фермент эндотелиальную NO-синтазу (eNOS) [3].
Таким образом, комбинация АТ (1–7)/аламандин может быть эффективным путем снижения вазоконстрикции, эндотелиальной дисфункции, воспаления и процессов пролиферации, активированных комплексом АТ II/ AT1-R .
БОЛЕЗНИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Компоненты РАС принимают участие в патогенезе самых распространенных сердечно-сосудистых заболеваний: атеросклерозе, ишемии и инфаркте миокарда, гипертензии и др.
Участие РАС в атеросклерозе
Наиболее распространённый патологический процесс в сосудах, в котором важную роль играет РАС – это атеросклероз.
На начальном этапе атерогенеза под влиянием какого-либо патогенного фактора, например, повышенного гидростатического давления при артериальной гипертензии (АГ) формируется повреждение и/или дисфункция эндотелия. Повышается его проницаемость, и в базальной мембране сосудистой стенки накапливаются липопротеиды низкой плотности (ЛПНП). Эти ЛПНП поглощаются макрофагами, которые впоследствии превращаются в пенистые клетки. При этом эндотелиоциты и макрофаги синтезируют и секретируют большое количество медиаторов воспаления. Далее в интиму сосудистой стенки мигрируют гладкомышечные клетки (ГМК), где, во-первых, размножаются и также нерегулируемо, как и макрофаги, поглощают ЛПНП, постепенно превращаясь в пенистые клетки, а, во-вторых, продуцируя компоненты внеклеточного матрикса, способствуют образованию фиброзной капсулы, покрывающей бляшку. В совокупности эти процессы приводят как к образованию, так и росту атеросклеротических бляшек.
РАС оказывает влияние не только на функционирование ГМК и эндотелиоцитов сосудистой стенки, а также на ряд звеньев развития атеросклероза: воспаление, окислительный стресс, формирование дефектов межклеточного матрикса и эндотелиальную дисфункцию. Основным ангиотензином, приводящим к развитию этих патологических эффектов, является АТ II [2, 3, 8, 13].
Участие РАС в воспалении
АТ II стимулирует синтез ряда факторов транскрипции, в т. ч. ядерный фактор kB (Nf-kB). Его индукция приводит к увеличению экспрессии провоспалительных цитокинов – интерлейкина-6 и ФНО-α, моноцитарного хемоаттрактантного белка-1 и фактора роста тромбоцитов, которые усугубляют воспаление, повреждение эндотелия, а также миграцию и адгезию моноцитов, что приводит к еще большему увеличению количества медиаторов воспаления в сосудистой стенке и в дальнейшем — к ее фиброзу. Также NF-κB способствует экспрессии молекул адгезии, таких как молекула адгезии сосудистых клеток-1, молекула межклеточной адгезии-1, E-селектин и хемоаттрактантных белков, например, моноцитарный хемоаттрактантный белок‑1. Молекулы клеточной адгезии и провоспалительные цитокины привлекают к участку эндотелия с сформировавшейся дисфункцией моноциты, лимффоциты и тромбоциты. Все перечисленные эффекты АТ II на NF-kB опосредуются через AT1-R, поэтому блокаторы AT1-R значительно уменьшают воспаление.
Кроме клеток сосудистой стенки при воспаления элементы тканевой РАС экспрессируют также и лейкоциты: естественные клетки-киллеры секретируют ренин, ангиотензиноген, АПФ и AT2-R, макрофаги продуцируют АПФ и АПФ 2, а при некоторых условиях и лиганды противовоспалительного рецептора Mas АТ (1–9) и АТ (1–7). При отсутствии MasR у мышей в эксперименте после введения бактериальных липополисахаридов воспалительная реакция усиливается по сравнению с мышами дикого типа [2, 8].
Таким образом, интенсивность воспалительного процесса в сосудистой стенке определяется в том числе и соотношением провоспалительных и противовоспалительных ангиотензинов.
Формирование оксидативного стресса под влиянием РАС. Одним из механизмов, посредством которых АТ II приводит к повреждению сосудов, является стимуляция образования АФК в различных клетках сосудов, включая гладкомышечные клетки, эндотелиальные клетки и адвентициальные фибробласты. АТ II, действуя через AT1-R, стимулирует в клетках экспрессию и активацию НАДФH-оксидазы, что приводит к увеличению образования супероксиданиона (рис. 2).
Основным местом образования АФК являются митохондрии, где они образуются вследствие утечки электронов из дыхательной цепи. Умеренное образование АФК необходимо для нормального функционирования клеток. Например, они участвуют в синтезе различных видов эйкозаноидов, оказывающих влияние на тонус ГМК и, способствующих таким образом вазодилатации или вазоконстрикции.
При чрезмерной активации путей синтеза АФК, их концентрация резко возрастает и сформировавшийся дисбаланс между АФК и антиоксидантами, вызывает инактивацию NO•, окисление липидов, модификацию ДНК и белков, а также увеличение синтеза молекул адгезии, провоспалительных цитокинов и матриксных металлопротеиназ. Все эти процессы приводят к формированию оксидативного стресса.
АТ II вызывает дисфункцию митохондрий, приводя с одной стороны к увеличению синтеза АФК, и с другой стороны – к снижению содержания в митохондриях антиоксиданта глутатиона. При этом, АФК, в свою очередь, вызывают повышенную экспрессию AT1-R, тем самым модулируя выработку активных форм кислорода и создавая порочный круг.
Оксидативный стресс активирует ряд сигнальных путей, включающих митоген-активируемую протеинкиназу, тирозинкиназу, протеинтирозинфосфатазу, кальциевые каналы и редокс-чувствительные факторы транскрипции. Активация всех этих факторов приводит к усилению миграции и пролиферации клеток, экспрессии провоспалительных генов, повышению синтеза внеклеточного матрикса и апоптозу клеток сосудистой стенки. Все эти процессы являются звеньями эндотелиальной дисфункции и способствуют ремоделированию сосудов.
Кроме того, АФК в стенке сосудов вызывают оксидативную модификацию липопротеинов низкой плотности (ЛПНП) и образование модифицированных ЛПНП (ЛПНПм). Такие модифицированные частицы ЛПНПм более атерогенны, поскольку они не могут поступать в клетки рецепторно-опосредовынным эндоцитозом и поглощаются только макрофагами и гладкомышечными клетками сосудов через низкоспецифичные рецепторы-мусорщики [13, 14, 15].
Терапевтическое воздействие на АФК с помощью митохондриально-адресованных антиоксидантов уменьшает эндотелиальную дисфункцию и способствует увеличению синтеза медиаторов-вазодилататоров (например, NO•), что приводит к снижению артериального давления при гипертензии.
Дефекты внеклеточного матрикса. Внеклеточный матрикс состоит из макромолекул, включая коллаген, эластин и протеогликаны. Эти молекулы обеспечивают структурную поддержку клеток и тканей и контролируют такие процессы, как адгезия, миграция, пролиферация и дифференцировка клеток, и изменение тонуса сосудов.
Элементы РАС принимают участие в изменении соотношения компонентов межклеточного матрикса в процессе атерогенеза, модифицируя метаболизм ГМК сосудистой стенки. АТ II вызывает пролиферацию и миграцию ГМК к наружному слою атеросклеротических бляшек, и где они продуцируют факторы роста и белки внеклеточного матрикса: коллаген, фибронектин, ламинин и тенасцин (гликопротеин, который синтезируется при травмах тканей). Синтезируя эти элементы фиброзной капсулы, ГМК способствуют, с одной стороны, стабилизации бляшки, а с другой – её увеличению, что может привести к окклюзии и возникновению острых осложнений. Поэтому, ингибирование миграции и пролиферации гладкомышечных клеток может быть полезным для предотвращения острых осложнений, хотя в то же время оно может влиять на стабильность бляшек [13].
Влияние АТ II на формирование эндотелиальной дисфункции. АТ II, локально продуцируемый эндотелиальным АПФ, является одним из ключевых веществ, влияющих на функцию эндотелия.
Сосудистый тонус – это результат баланса между осью АПФ/АТ II/AT1-R, вызывающей вазоконстрикцию и осями АПФ/АТ II/AT2-R, АПФ 2/АТ (1–7)/MasR, АПФ 2/АТ (1–9)/АТ2-R, приводящими к вазодилатации (рис. 4).
При повышенном активации оси АПФ/АТ II/AT1-R и снижении синтеза NO• формируется эндотелиальная дисфункция, инициирующая начало формирования атеросклеротического процесса [13].
Ишемическая болезнь сердца
Ишемическая болезнь сердца (ИБС) развивается при ограничении кровотока в коронарных сосудах. Элементы РАС оказывают влияние на многие звенья патогенеза ИБС.
Одна из главных причин ишемии – формирование атеросклеротических бляшек, которые уменьшают просвет сосудов и снижают доставку кислорода к кардиомиоцитам. Гиперактивация РАС усугубляет такие звенья развития атеросклероза, как воспаление, повреждение эндотелия, миграцию и адгезию моноцитов. В свою очередь ишемия усугубляет процесс атерогенеза. В клетках сосудистой стенки увеличивается экспрессия генов различных факторов роста, что приводят к пролиферации клеток, повышенному синтезу фибрина и коллагена, и, соответственно, росту бляшек и утолщению сосудов [2].
Не менее важную роль в развитии ИБС играет тромбообразование в месте атеросклеротического поражения сосуда. При этом активное участие в инициации процессов тромбообразования принимают компоненты РАС. Например, АТ II опосредованно через АФК увеличивает синтез эндотелиоцитами молекул клеточной адгезии (рис. 2) и активирует тромбоцитарный гемостаз. Хроническая инфузия АТ II индуцирует адгезию тромбоцитов к эндотелиальным клеткам и ускоряет образование тромбов как в крупных артериях, так и в артериолах. С другой стороны, АТ II непосредственно активирует тканевой фактор, который совместно с фактором VII запускает внешний механизм коагуляционного гемостаза. Также АТ II стимулирует экспрессию ингибитора активатора плазминогена-1 через AT1-R в почках и печени, тем самым снижая фибринолитическую активность крови. Все эти механизмы увеличивают вероятность тромбообразования, приводящего к еще большей ишемии миокарда [2, 16].
Ангиотензины – антагонисты АТ II (АТ (1–7) и АТ (1–9)) оказывают в развитии ИМ кардиопротекторные эффекты. Введение крысам с ИМ АТ (1–7) уменьшало очаг некроза на 50 % и улучшало сердечную сократимость.
Усиление экспрессии генов, участвующих в образовании АТ (1–7), уменьшает повреждение миокарда, вызванное длительной ишемией и последующей реперфузией у крыс. У трансгенных крыс с избыточным уровням АТ (1–7) реже формируются постреперфузионные аритмии. Однако, потеря АПФ 2 еще больше усугубляет повреждение сердца [17].
Определенную защитную функцию в постишемическом ремоделировании сердца выполняет AT2-R. У мышей, лишенных этого рецептора, наблюдается более тяжелое развитие сердечной недостаточности после ИМ. Соответственно, у трансгенных мышей со сверхэкспрессией AT2-R функция левого желудочка после инфаркта миокарда улучшалась.
Доказано положительное влияние АТ (1–9) на течение ИМ у мышей. Доставка этого ангиотензина с помощью вектора мышам с ИМ приводила к снижению частоты смерти и улучшению функции левого желудочка по сравнению с контрольными мышами [17].
Схожий результат был получен в эксперименте с изолированными сердцами крыс, подвергнутыми ишемии и реперфузии. Инфузия АТ (1–9) уменьшала размер инфаркта, апоптотическую и некротическую гибель кардиомиоцитов [17].
Сердечная недостаточность
Сердечная недостаточность – это серьезное заболевание, которое характеризуется снижением функциональной активности миокарда. Одним из включающихся компенсаторных механизмов, является гиперактивация симпато-адреналовой системы. Выделившиеся катехоламины вызывают вазоконстрикцию и уменьшают перфузию почек. Это приводит к активации РАС и выделению ренина. В итоге длительный повышенный уровень АТ II способствует развитию гипертрофии миокарда и других патологических изменений в сердечной ткани. У пациентов с выраженной СН уровни ренина и альдостерона в плазме постоянно повышены. В ремоделировании миокарда принимают участие компненты РАС с противоположными эффектами [2].
Согласно современным представлениям, локальная и гуморальная РАС оказывают влияние на сердце и кровеносные сосуды, действуя независимо друг от друга. Например, как уже говорилось выше, при развитии СН в сердце резко возрастает концентрация АТ II. Основным ферментом, отвечающим за образование АТ II в сердце и сосудах, является химаза.
При сердечной недостаточности активируются оба пути образования АТ II тканевой РАС: АПФ-зависимый и химазозависимый, что приводит увеличению продукции этого ангиотензина.
Исследования по уменьшению негативного ремоделирования миокарда при СН проводятся по нескольким направлениям. Например, было показано, что ингибирование химазы совместно с ингибированием АПФ приводит к улучшению функции сердца и уменьшению ремоделирования миокарда. Введение же специфического ингибитора химазы показало положительный эффект в лечении ИМ и СН у человека и животных [4]. Таким образом, понимание взаимодействия системной и тканевой РАС играет важную роль в понимании патологических процессов в сердце и сосудах [2, 18].
Другие исследования направлены на изучение ангиотензинов с защитным действием. Введение мышам дикого типа АТ II приводило к повышению уровня артериального давления, гипертрофии миокарда, фиброзу и диастолической дисфункции, и эти эффекты усугублялись у мышей с дефицитом АПФ 2. И наоборот, введение мышам дикого типа человеческого рекомбинантного АПФ 2, снижало индуцированное АТ II образование супероксида и тормозило процесс гипертрофии сердца, что подчеркивает защитную роль этого фермента в развитии СН [19].
Введение АТ (1–7) и аламандина также может оказывать благоприятное воздействие на сердечную ткань и сосуды, предотвращая их ремоделирование. У мышей с дефицитом рецептора MrgD, через который реализует эффекты аламандин и АТ (1–7), наблюдается ремоделирование и дисфункция левого желудочка, приводящие к дилатационной кардиомиопатии [7, 12].
Артериальная гипертензия
Артериальная гипертония (АГ) затрагивает более четверти взрослого населения в развитых странах, что представляет собой серьезную проблему для здоровья. Гипертония приводит к ряду патологических состояний, включая почечную недостаточность, застойную сердечную недостаточность, инсульт и инфаркт миокарда. Одним из основных регуляторов давления крови является система ангиотензинов. Участие РАС в развитии гипертензии проявляется в увеличении объема циркулирующей крови (ОЦК) и повышении тонуса сосудов на ранних этапах развития процесса и их ремоделирования на более поздних этапах. Повышение ОЦК опосредовано увеличением секреции альдостерона клубочковой зоны коры надпочечников, который действует на почки и увеличивает реабсорбцию натрия, хлора и воды.
Влияние РАС на сосудистый тонус и функцию эндотелия осуществляется за счет противоположных эффектов, реализуемых ангиотензинами-антагонистами через разные виды рецепторов.
Вазоконстрикция развивается под влиянием АТ II, действующего через АТ1-R. При этом включаются фосфолипаза С-зависимые механизмы, в результате активации которых образуются инозитол-3-фосфат (ИФ3) и диацилглицерин (ДАГ). ИФ3 мобилизует кальций в саркоплазму, что приводит в краткосрочной перспективе к сокращению миофибрилл мышечных клеток (рис. 2).
Кальмодулин зависимая протеникиназа может воздействовать на ядро и изменять экспрессию генов, участвующих в развитии гипертрофии. Образовавшийся ДАГ активирует протеинкиназу С, в результате чего активируются процессы воспаления миокарда: оксидативный стресс, синтез молекул клеточной адгезии, пролиферация фибробластов. Кроме того, при связывании АТ II с АТ1-R происходит активация НАДФН-оксидазы и увеличение образования АФК, что приводит к увеличению экспрессии генов, результатом чего является гипертрофия, повреждение ДНК, повреждение сосудов и смерть клеток [2, 3, 8, 15].
Параллельно активация АТ1-R снижает парасимпатический тонус, чувствительность барорецепторов и выработку вазодилататора NO•.
Эффекту оси АТ II/AT1-R противодействуют эффекты осей АТ II/AT2-R, АТ (1–7)/MasR, АТ (1–9)/АТ2-R. Активация AT2-R и MasR вызывает снижение артериального давления, фиброза и воспаления, увеличивает вазодилатацию, продукцию NO•, чувствительность бароререцепторов и натрийурез [8, 11].
Еще один ангиотензин с антигипертензивным действием — АТ IV — через AT4-R увеличивает почечный кровоток, вазодилатацию, продукцию NO• и натрийурез [19].
Коррекция нарушений ренин-ангиотензиновой системы
С фармакологической точки зрения РААС является одной из часто используемых систем для лечения АГ, СН, ИМ. Фармакологические вмешательства в РААС в основном включают ингибиторы АПФ, блокаторы АТ1-R, вещества, опосредованно снижающие синтез ренина (блокаторы β1-адренорецепторов (β1-АR)) и прямые ингибиторы активности ренина (рис. 5).
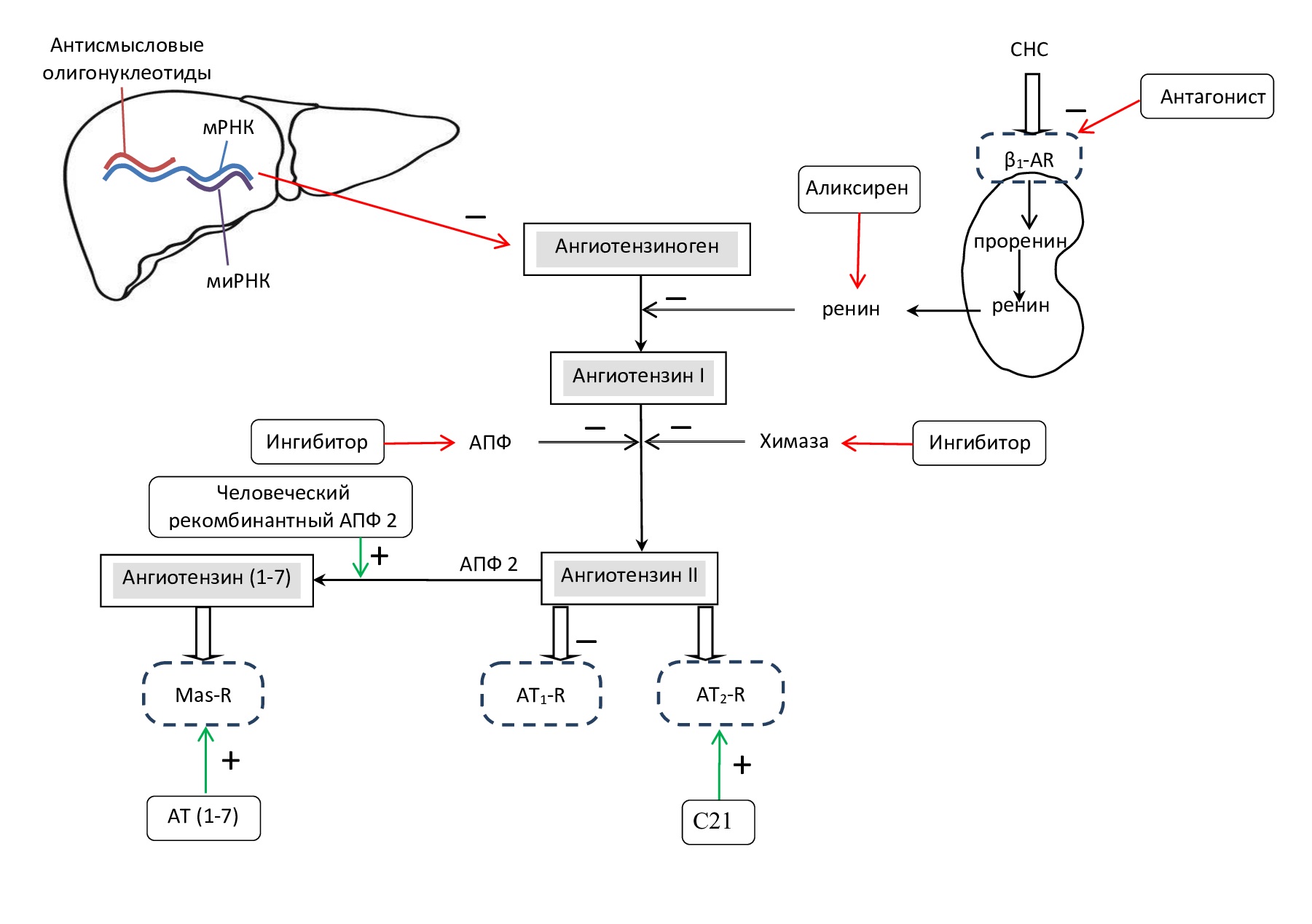
Рис. 5. Мишени лекарственных препаратов, действующих на РАС
«+» стимуляция эффекта, «–» торможение эффекта
Ингибиторы АПФ напрямую ингибируют сосудосуживающие и пролиферативные эффекты уже известной оси AПФ/AТ II/AT1-R и опосредованно стимулируют продукцию вазопротективного и антипролиферативного пептида AТ (1–7) [20, 21]. Важно учитывать, что ингибиторы АПФ полностью не блокируют синтез АТ II, поскольку не затрагивают химазозависимый путь образования этого АТ. Поэтому для более комплексного снижения активности РАС используют селективные блокаторы АТ1-R. Их основным эффектом является торможение вазоконстрикции, т. е. снижение периферического сосудистого сопротивления без существенного влияния на частоту сердечных сокращений [20].
Блокаторы β1-АR нарушают передачу импульсов на уровне пресинаптических окончаний адренергических нейронов, уменьшая тонус приносящих артериол, что приводит к снижению уровня ренина в плазме и, соответственно, снижению образования AТ II. Также эти препараты уменьшают превращение проренина в ренин [20].
Снижение активности ренина, как первого этапа каскада РААС, стала возможной в 2007 году с одобрением алискирена, первого перорально активного прямого ингибитора ренина, доступного для клинического применения. Этот препарат показал антигипертензивную и органопротекторную (кардиопротекторную, ренопротекторную), а также антифибротическую активность. Кроме того, ингибитор ренина снижает его антидиуретический эффект [23].
Поскольку образование АТ II в миокарде во многом зависит от химазы – фермента, активность которого увеличивается при СН [6], перспективным направлением является поиск его ингибитора. На животных показано, что ингибиторы химазы предотвращают пролиферацию сосудов, фиброз миокарда после ИМ [5].
Получены положительные результаты стимуляции AT2-R. Его агонист С21 (Buloxibutid) в эксперименте на животной модели показал органопротекторное, противовоспалительное, антитромботическое, антифиброзное и антиапоптотическое действие [4].
Еще одним направлением исследования воздействия на различные звенья РАС является поиск путей подавления в печени экспрессии гена ангиотензиногена. Эти исследования ведутся в двух направлениях: изучаются возможности применения антисмысловых олигонуклеотидов и малых интерферирующих рибонуклеиновых кислот (мРНК). Антисмысловые олигонуклеотиды связываются с целевой РНК и, активируя эндогенную РНКазу, разрушают мРНК ангиотензиногена. Второй путь – разрушение мРНК ангиотензиногена с помощью процесса РНК-интерференции (деградации мРНК после связывания с малой интерферирующей РНК). Предполагается, что эти методы воздействия на РАС будут более специфичны и иметь меньшее количество побочных эффектов [22].
Открытие в последние десятилетия новых компонентов РАС, оказывающих защитное действие, позволило начать разрабатывать новые направления лечения сердечно-сосудистых заболеваний. Используя протекторное действие оси АПФ 2/АТ (1–7)/MasR, в настоящее время изучается терапевтическое значение комплексного воздействия на нее различных лигандов.
Активация защитной оси РАС AПФ 2/AТ (1–7)/MasR обеспечивает благоприятные сосудистые эффекты. Целью этой терапевтической мишени является усиление эффекта AПФ 2, снижение уровня циркулирующего AТ II и перенаправление метаболизма ангиотензинов в сторону повышенного образования AТ (1–7), который, воздействуя на AT2-R и Mas-рецепторы, достигает своего защитного эффекта. Известно, что введение человеческого рекомбинантного AПФ 2 оказывает антигипертензивный эффект. Вирус-опосредованная экспрессия гена AПФ 2, то есть генная терапия, продемонстрировала кардиопротекторный и антигипертензивный эффекты на животных моделях [2].
Аналог AТ (1–7), хотя и является очень привлекательной терапевтической мишенью, но сегодня количество исследований по его применению очень ограничено из-за короткой продолжительности жизни этого гормона. Ингибиторы АПФ и антагонисты рецепторов АТ II своим действием косвенно перенаправляют метаболический путь РАС в сторону формирования повышенного уровня AТ (1–7) [2].
Осознание того, что внутри РАС существует защитная ось, привело к тому, что фармакотерапия и генная терапия все больше фокусируются на активации защитных компонентов РАС.
Список литературы
1. World Health Organization: global website. Available at: https://www.who.int/ru [accessed: 17.06.2024].
2. World Health Organization: global website. Cardiovascular diseases. Available at: https://www.who.int/ru/health-topics/cardiovascular-diseases#tab=tab_1 [accessed: 17.06.2024].
3. Capric V., Priyan Chandrakumar H., Celenza-Salvatore J.N., Makaryus A. The Role of the Renin-Angiotensin-Aldosterone System in Cardiovascular Disease: Pathogenetic Insights and Clinical Implications [Internet]. Renin-Angiotensin Aldosterone System. IntechOpen; 2021. Available from: DOI:10.5772/intechopen.96415
4. Paul M., Poyan Mehr A., Kreutz R. Physiology of local renin-angiotensin systems. Physiol Rev. 2006;86(3):747-803. DOI:10.1152/physrev.00036.2005
5. Ahmad S., Ferrario C.M. Chymase inhibitors for the treatment of cardiac diseases: a patent review (2010-2018). Expert Opin Ther Pat. 2018;28(11):755-764. DOI:10.1080/13543776.2018.1531848
6. Froogh G., Pinto J.T., Le Y. et al. Chymase-dependent production of angiotensin II: an old enzyme in old hearts. Am J Physiol Heart Circ Physiol. 2017;312(2):H223-H231. DOI:10.1152/ajpheart.00534.2016
7. Sun Y., Weber K.T. Angiotensin-converting enzyme and wound healing in diverse tissues of the rat. J Lab Clin Med. 1996;127(1):94-101. DOI:10.1016/s0022-2143(96)90170-5
8. Martyniak A., Tomasik P.J. A New Perspective on the Renin-Angiotensin System. Diagnostics (Basel). 2022;13(1):16. DOI:10.3390/diagnostics13010016
9. Paz Ocaranza M., Riquelme J.A., García L. et al. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat Rev Cardiol. 2020;17(2):116-129. DOI:10.1038/s41569-019-0244-8
10. Turner A.J., Nalivaeva N.N. Angiotensin-converting enzyme 2 (ACE2): Two decades of revelations and re-evaluation. Peptides. 2022;151:170766. DOI:10.1016/j.peptides.2022.170766
11. Hilgers K.F., Kuczera M., Wilhelm M.J. et al. Angiotensin formation in the isolated rat hindlimb. J Hypertens. 1989;7(10):789-798. DOI:10.1097/00004872-198910000-00004
12. Kaschina E., Unger T. Angiotensin AT1/AT2 receptors: regulation, signalling and function. Blood Press. 2003;12(2):70-88. DOI:10.1080/08037050310001057
13. Hrenak J., Paulis L., Simko F. Angiotensin A/Alamandine/MrgD Axis: Another Clue to Understanding Cardiovascular Pathophysiology. Int J Mol Sci. 2016;17(7):1098. DOI:10.3390/ijms17071098
14. van Thiel B.S., van der Pluijm I., te Riet L. et al. The renin-angiotensin system and its involvement in vascular disease. Eur J Pharmacol. 2015;763(Pt A):3-14. DOI:10.1016/j.ejphar.2015.03.090
15. Le NA. Lipoprotein-associated oxidative stress: a new twist to the postprandial hypothesis. Int J Mol Sci. 2014;16(1):401-19. DOI:10.3390/ijms16010401
16. Romero J.C., Reckelhoff J.F. Role of Angiotensin and Oxidative Stress in Essential Hypertension. Hypertension. 1999;34(4):943-949. DOI:10.1161/01.HYP.34.4.943
17. Fang C., Schmaier A.H. Novel anti-thrombotic mechanisms mediated by Mas receptor as result of balanced activities between the kallikrein/kinin and the renin-angiotensin systems. Pharmacol Res. 2020;160:105096. DOI:10.1016/j.phrs.2020.105096
18. Paz Ocaranza M., Riquelme J.A., García L. et al. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat Rev Cardiol. 2020;17(2):116-129. DOI:10.1038/s41569-019-0244-8
19. Flores-Monroy J., Lezama-Martínez D., Martínez-Aguilar L. Function of renin angiotensin system on heart failure. Journal of Integrative Cardiology. 2016;2(5):380-386. DOI:10.15761/JIC.1000180
20. Zhong J., Basu R., Guo D. et al. Angiotensin-converting enzyme 2 suppresses pathological hypertrophy, myocardial fibrosis, and cardiac dysfunction. Circulation. 2010;122(7):717-728. DOI:10.1161/CIRCULATIONAHA.110.955369.
21. Kibel A, editor. Selected Chapters from the Renin-Angiotensin System [Internet]. IntechOpen; 2020. Available from: http://dx.doi.org/10.5772/intechopen.77666
22. Харкевич Д.А. Фармакология. М.:ГЭОТАР-Медиа; 2021. [Kharkevich D.A. Pharmacology. M.:GEOTAR-Media; 2021 (In Russian)].
23. Cruz-López E.O., Ye D., Wu C. et. Angiotensinogen Suppression: A New Tool to Treat Cardiovascular and Renal Disease. Hypertension. 2022;79(10):2115-2126. DOI:10.1161/HYPERTENSIONAHA.122.18731
24. Pantzaris N.D., Karanikolas E., Tsiotsios K., Velissaris D. Renin Inhibition with Aliskiren: A Decade of Clinical Experience. J Clin Med. 2017;6(6):61. DOI:10.3390/jcm6060061
Об авторах
Людмила Олеговна ГуцолРоссия
к.б.н., доцент, доцент кафедры патологической физиологии и клинической лабораторной диагностики ФГБОУ ВО ИГМУ Минздрава России, Россия, 664003, г. Иркутск, ул. Красного Восстания, 1
Ирина Эдуардовна Егорова
Россия
Рецензия
Для цитирования:
Гуцол Л.О., Егорова И.Э. ВЛИЯНИЕ ТКАНЕВЫХ АНГИОТЕНЗИНОВ НА ЭЛЕМЕНТЫ КАРДИОВАСКУЛЯРНОЙ СИСТЕМЫ (ЛЕКЦИЯ 2). Байкальский медицинский журнал. 2024;3(3):71-82. https://doi.org/10.57256/2949-0715-2024-3-71-82
For citation:
Gutsol L.O., Egorova I.E. THE INFLUENCE OF TISSUE ANGIOTENSINS ON ELEMENTS OF THE CARDIOVASCULAR SYSTEM (LECTURE 2). Baikal Medical Journal. 2024;3(3):71-82. (In Russ.) https://doi.org/10.57256/2949-0715-2024-3-71-82
















