Перейти к:
ПИЩЕВОЙ МЕТАБОЛИЗМ И ОЖИРЕНИЕ. ЛЕКЦИЯ 1 (ПОТРЕБЛЕНИЕ И ДЕПОНИРОВАНИЕ)
https://doi.org/10.57256/2949-0715-2023-4-72-84
Аннотация
Высокая распространённость людей с излишним весом и ожирением стала международной социальной проблемой. В России каждая четвертая женщина и каждый пятый мужчина имеют избыточный вес.
Ожирение является следствием нарушения баланса между потреблением и расходованием пищевой органики. Различимы две причины переедания – наследственные метаболические нарушения и бытовая гиперфагия. Главной причиной ожирения современного человечества является бытовая гиперфагия.
Ожирение – это увеличение в теле человека числа и размера жировых клеток – адипоцитов. Увеличение числа клеток сопровождается увеличением числа капилляров и холестерина. Для содержания 1 кг адипоцитов требуется 100 км капилляров, а в 10 кг адипоцитов содержится 25 г холестерина. У людей с высоким индексом массы тела каждый килограмм жира требует на своё содержание 5,4 ккал/сут. Ожирение является причиной развития гипертензии, атеросклероза, инфаркта миокарда, аномального содержания липидов и диабета 2 типа.
Уделено внимание роли ацетил-КоА, который в цикле катаболизма белков, триглицеридов и глюкозы является общим интермедиатом, способным участвовать в энергетическом и пластическом обменах. Показана гетерогенность клеток печени по способности депонировать гликоген и участвовать в глюконеогенезе.
В процессе потребления и расходования пищевая органика вначале депонируется в форме гликогена, триглицеридов и белков. Расходование депонированных веществ контролируется основным обменом, термогенезом и психофизической активностью индивидуума. На долю основного обмена приходится 50-70 % общего расходования вещества и энергии. При этом затраты вещества и энергии на основной обмен происходят автоматически. Первоочередная задача – снабжение кислородом, работа сердца, работа почек и десятки сотен метаболических реакций осуществляются без нашего сознательного участия.
В условиях регулярного и частого питания потребности основного обмена обеспечивают гликогенолиз и гликолиз. В условиях голодания и физической активности становятся востребованы триглицериды, которые через гидролиз и последующее окисление жирных кислот превращаются в ацетил-КоА и используются в цикле трикарбоновых кислот. В условиях регулярного, избыточного питания и низкой физической активности триглицериды адипоцитов организмом востребованы только на основной обмен.
Ключевые слова
Для цитирования:
Майборода А.А. ПИЩЕВОЙ МЕТАБОЛИЗМ И ОЖИРЕНИЕ. ЛЕКЦИЯ 1 (ПОТРЕБЛЕНИЕ И ДЕПОНИРОВАНИЕ). Байкальский медицинский журнал. 2023;2(4):72-84. https://doi.org/10.57256/2949-0715-2023-4-72-84
For citation:
Mayboroda A.A. FOOD METABOLISM AND OBESITY. REPORT 1 (CONSUMPTION AND DEPOSITION). Baikal Medical Journal. 2023;2(4):72-84. (In Russ.) https://doi.org/10.57256/2949-0715-2023-4-72-84
Высокая распространённость людей с избыточным весом и ожирением во всем мире стала опасной для жизни социальной проблемой. На территории России каждая четвертая женщина и каждый пятый мужчина страдает ожирением.
Ожирение – это увеличение в теле человека числа и размера жировых клеток – адипоцитов выше нормы 25 кг/м2. Во всем мире принят показатель индекс массы тела (ИМТ), который определяется как отношение веса в килограммах к квадрату роста в метрах (рис. 1):
ИМТ = Вес (кг) / Рост (м2)
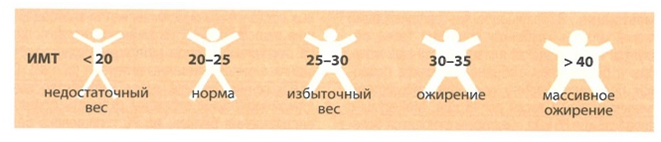
Рис 1. ИМТ, как показатель количества жировых клеток в теле человека [1]
Людей с ИМТ выше 25 кг/м2 относят к группе избыточный вес, а с ИМТ выше 30 кг/м2 к группе ожирение.
Ожирение формируется в процессе переедания (гиперфагии). Переедание возникает или как следствие метаболических дефектов или в процессе бытовой гиперфагии (рис. 2):
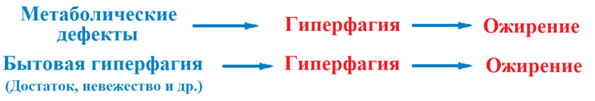
Рис 2. Гиперфагия – ведущая причины ожирения [1]
Доля людей с метаболическими дефектами, приводящими к патологическому перееданию ничтожно мала. В частности при синдроме Прадера-Вилли отмечена фенотипическая гиперфагия, однако частота синдрома в популяции составляет 1:10000, 1:15000 новорожденных. Самое распространенное генетическое нарушение катаболизма жирных кислот (ЖК), возникающее в результате мутации в гене, кодирующем ацил-Ко-дегидрогеназу, определено с частотой 1:10000 новорожденных при гомозиготном носительстве [1]. Очевидно, что генетические дефекты метаболизма не могут быть причиной массового ожирения людей на планете Земля. В частности в США 30 % взрослого населения страдает ожирением, а у 35% избыточный вес [1,2,3].
Первостепенную роль гиперфагии в увеличении ИМТ демонстрирует история массового ожирения коренных жителей островного Тихоокеанского региона. Историческая правда такова, что в начале прошлого столетия людей с избыточным весом и ожирением на островах практически не было. Колонизация региона товарами и продуктами питания, смена образа жизни и неправильная стратегия питания привели к тому, что в начале 21 века более 70 % граждан островного региона в возрасте от 15 лет страдают от ожирения. По количеству ожиревших Тихоокеанские островные государства занимают первые восемь мест среди стран мирового сообщества. Ожирение рассматривается как признак богатства, ассоциировано с властью, красотой, удовлетворенностью и ощущением здоровья. Ожирение приводит к росту симптомов метаболического синдрома и СД 2 типа. Частота СД 2 типа среди возрастной группы 55-64 года достигает 45 %, вследствие чего у них сокращена продолжительность жизни [4].
Среди метаболических дефектов синдром Прадера-Вилли хорошо иллюстрирует причины ожирения. Фенотипическая гиперфагия при синдроме развивается у детей между первым и шестым годом жизни. На фоне постоянно высокой концентрации грелина (постоянное чувство голода) происходит чрезмерное и беспорядочное поедании пищи, которое приводит к ожирению и становится причиной смерти [5]. Этот пример хорошо иллюстрирует правило о том, что переедание является главной причиной ожирения. Стоит обратить внимание на важную деталь – темпы потребления пищи пропорциональны скорости ожирения и скорости наступления смерти индивидуума, быстрое накопление триглицеридов – быстрая смерть.
Норму адипоцитов тела регулирует система «адипостат», которая включает две группы нейронов в гипоталямусе и ряд гормонов [6,7]. 8-10 кг триглицеридов (ТГ) у человека весом 70 кг при росте 1,7 метра распределены так, что он воспринимается как находящийся в спортивной форме. ИМТ более 30-35 кг/ м² оценивается как массивное ожирение (рис. 3).
А Б В
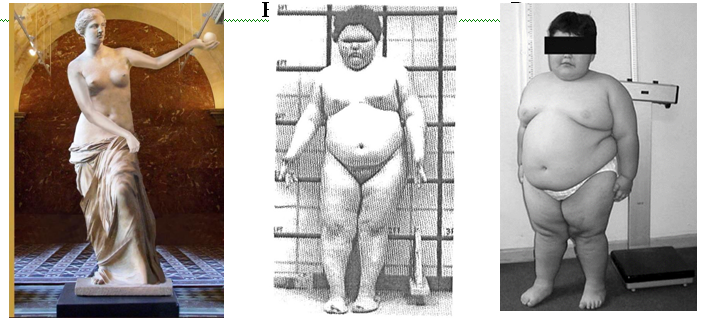
Рис 3. Венера Милосская демонстрирует нормальный ИМТ (А). Ожирение у пациентов с остеодистрофией Олбрайта (Б) и с синдромом Прадера-Вилли (В) [1].
Ожирение и метаболический синдром
В современной медицинской практике сложилось представление о метаболическом синдроме (синдром Х), который включает симптомы – ожирение, гипертензия, атеросклероз, инфаркт миокарда, аномальное содержание липидов крови. Эти симптомы являются предшественниками диабета 2 типа. Очевидно, что ожирение следует обозначить не в числе симптомов, а в роли причины развития гипертензии, атеросклероза, инфаркта миокарда, аномального содержания липидов [1].
Первично проявляющимся симптомом является гипертензия. Очевидная зависимость состояния кровяного давления от числа адипоцитов заключается в том, что каждый адипоцит нуждается в персональном кровеносном капилляре, один кг жира содержит 100 км капилляров, а 20 кг адипоцитов 2000 км капилляров. Накопление ТГ сопровождается увеличением числа жировых клеток и питающих их сосудов. Наличие 2000 км капилляров очевидная постоянная нагрузка на сердечную мышцу – отсюда и гипертензия.
Дислипидемии крови
Пищевые ТГ проходят сложный путь транспортировки от тонкого кишечника до адипоцитов.
Перед упаковкой в хиломикроны (ХМ) ТГ гидролизуются до жирных кислот (ЖК), в процессе упаковки ЖК этерифицируются в ТГ, в капиллярах жировых клеток ТГ под действием липопротеинлипазы повторно гидролизуется на ЖК и глицерин, ЖК поступают в адипоциты и опять этерифицируются в ТГ. Триглицеридовая капля в адипоцитах становится эндогенными триглицеридами [6,7,8,9].
Эндогенные ТГ расходуются в процессе липолиза. В ходе данного процесса ЖК освобождаются из состава ТГ и поступают в кровь. В плазме крови ЖК покрываются гидратной оболочкой, теряют подвижность, и дальнейший транспорт ЖК осуществляют альбумины сыворотки крови. При этом 75 % всех ЖК, освобождаемых при липолизе, повторно этерифицируется в адипоцитах и не используется в клеточном метаболизме. Этот сложный многокомпонентный процесс метаболизма ТГ рассчитан на 10-12 кг депонированных в адипоцитах ТГ. Однако при ИМТ превышающим 30 кг/м2 возникают проблемы с местом хранения ТГ, так как способность адипоцитов запасать ТГ исчерпана. В этой связи повышается экспрессия генов, контролирующих развитие новых адипоцитов в печени и в скелетных мышцах, где возникают новые скопления клеток жировой ткани [1,7].
Чрезмерные по объему скопления адипоцитов опережают рост капилляров для их снабжения, возникают условия гибели адипоцитов, путем апоптоза или некроза. Большие объемы ТГ и эктопические места их локализации вызывают нарушения скорости и последовательности транспорта липидов и определяют их аномальное содержание в крови [1].
Кроме аномального содержания ТГ у людей с высоким ИМТ наблюдается высокий уровень холестерина (ХС), содержание которого пропорционально числу адипоцитов. Каждая новая порция адипоцитов содержит 2,5 мг на 1 г ткани [10]. 20 кг жировой ткани накапливают 50 г ХС, при суточной потребности человека 1,2 г [10].
Ожирение и симптомы метаболического синдрома являются предшественниками СД 2 типа, главной проблемой которого признается устойчивость к инсулину. Механизм утраты чувствительности к инсулину остается не расшифрованным, однако получены косвенные доказательства существования патологического гена сахарного диабета. В пользу подобной точки зрения можно трактовать факт о том, что только 80 % особей с диабетом имеют высокий ИМТ [10].
Потребление, депонирование
Клетки человека состоят из трех основных классов органических соединений – белков (Б), липидов (Л) и углеводов (Угл). Эти три соединения совмещены в единую структурно-функциональную систему, которая надежно обеспечивает человеческий организм веществом и энергией. Подсчитано, что в результате тысяч метаболических реакций за сутки в человеческом теле расходуется и синтезируется заново 64 кг АТФ [11,12]. Источником АТФ являются белки, липиды и углеводы, которые должны постоянно пополняться, поэтому люди едят то, из чего состоят. Вся пищевая органика представлена белками, липидами и углеводами [10].
Уникальное устройство биологических систем заключается в том, что вещество и энергия идут единым потоком, являются участниками и энергетического метаболизма и структурной организации, при этом масса клеток не меняется, но молекулы белков, липидов и углеводов существуют в клетках ограниченное время. Системы, в которых масса клеток не меняется, а молекулы заменяются новыми называются системами текучего обновления [10].
Расходование большей части пищевой органики в человеческом организме совершается непрерывно, автоматически без нашего сознательного участия в ходе основного обмена, но поступление пищи происходит периодически, поэтому расходование осуществляется путем предварительного депонирования вещества в форме гликогена (ГГ) в печени и мышцах, триглицеридов в адипоцитах, белков в мышечной ткани и последующей их утилизации путем гликогенолиза, гликолиза, глюконеогенеза, липолиза, дезаминирования и других форм окисления. Наличие депонированных запасов – это условие устойчивого обеспечения основного обмена, который должен осуществляться постоянно и непрерывно [10].
Однако утилизировать ГГ, ТГ и Б клетки не могут, доступными для клеточного метаболизма являются аминокислоты (АК), жирные кислоты (ЖК) и глюкоза (ГЛ). В процессе полостного пищеварения белки гидролизуются на аминокислоты (АК), липиды на глицерин и жирные кислоты (ЖК), полисахариды на моносахариды (рис. 4) [10].
АК, ЖК и ГЛ внутриклеточно в результате последовательных реакций окисления превращаются в ацетил-КоА. Судьба ацетил-КоА зависит от потребности многоклеточного организма, ацетил-КоА может быть использован как для пластического, так и для энергетического обмена (рис. 4,5) [10].
При этом клетки проявляют органоспецифичность по способности метаболизировать пищевую органику. Так эритроциты, которые не имеют митохондрий, для синтеза АТФ могут использовать только гликолиз, поэтому эритроцитам постоянно нужна глюкоза. Гепатоциты синтезируют АТФ из ЖК. Нейроны головного мозг метаболизируют глюкозу для выработки АТФ, а для сердечной мышцы главным энергетическим источником непрерывных сокращений являются ЖК. Очевидно, что органоклеточная специфика депонирования и утилизации пищевой органики лежит в основе понимания причин чрезмерного увеличения индекса массы тела [10].
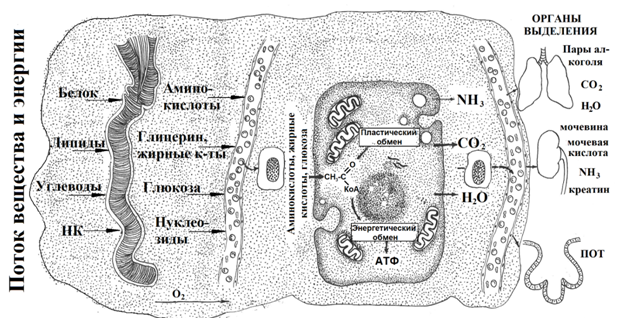
Рис 4. Пути транспорта и внутриклеточная утилизация пищевой органики. Условия жизнедеятельности обеспечивает комплекс: (белки + липиды + углеводы + O2 + Н2O) + T [8,13].
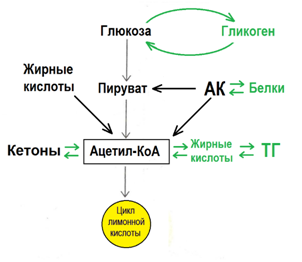
Рис 5. Ацетил-КоА может участвовать в цикле лимонной кислоты, образовывать кетоны, жирные кислоты и триглицериды. Гликоген депонируется из глюкозы, белки из аминокислот, триглицериды депонируются из жирных кислот [8].
Депонирование и расход глюкозы обеспечивает оперативные потребности основного обмена и сознательной активности индивидуума. Приоритетными потребителями глюкозы крови являются печень, эритроциты, нейроны головного мозга и мозговое вещество почек. Печень контролирует концентрацию глюкозы в плазме крови на уровне 5 ммоль путем постоянной секреции в объеме 10 г в час. Постоянный уровень глюкозы крови обеспечивает непрерывную потребность эритроцитов и нейронов головного мозга энергией. Снабжение организма кислородом является первоочередным условием жизнедеятельности, ибо средний человек может не дышать около 2-5 минут, далее наступает смерть. Активность головного мозга полностью зависит от глюкозы крови, которой мозг потребляет 120 г в сутки. Снижение уровня глюкозы плазмы крови в два раза приводит к нарушению мозговой деятельности, снижение в пять раз приводит к коме и смерти. Кроме эритроцитов и головного мозга глюкоза является единственным источником энергии для тестикулярной ткани, мозгового вещества почек и эмбриональных тканей [1,12].
Поступление глюкозы в печень не зависит от действия инсулина. Печень депонирует глюкозу в форме гликогена и одновременно контролирует концентрацию глюкозы в плазме крови. Гликогенсинтезирующая и глюкозоутилизирующая функция печени осуществляется через глюкозо-шесть-фосфат (Г-6-Ф) [10].
Глюкоза в печени, под действием глюкокиназы превращается в Г-6-Ф, с участием которого осуществляется синтез и расщепление гликогена, дефосфорилирование Г-6-Ф и выход в кровь в форме глюкозы. В гепатоцитах через Г-6-Ф осуществляется гликогенез и глюконеогенез (рис. 6) [10].
Очевидно, что одновременное участие Г-6-Ф в синтезе гликогена и в глюконеогенезе противоречит принципу целесообразности – два разнонаправленных процесса на одной территории, одновременно идти не могут (рис. 6). Много лет существующее предположение о зональной гетерогенности печени сегодня подкреплено научными данными [14]. В частности установлено, что наибольшее количество гликогена содержится в гепатоцитах третьей зоны синусоида печени (рис. 7). В клетках третьей зоны определяется максимальная активность гликогенсинтетазы, гликогенсенфорилазы и глюкозо-шесть-фосфатазы (Г-6-Фазы) (рис. 8).
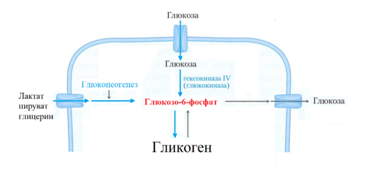
Рис 6. Пищевая глюкоза поступает в печень, где под действием глюкокиназы превращается в Г-6-Ф, который депонируется в виде гликогена. Г-6-Ф пополняется не только пищевой глюкозой, но и в процессе глюконеогенеза [8].
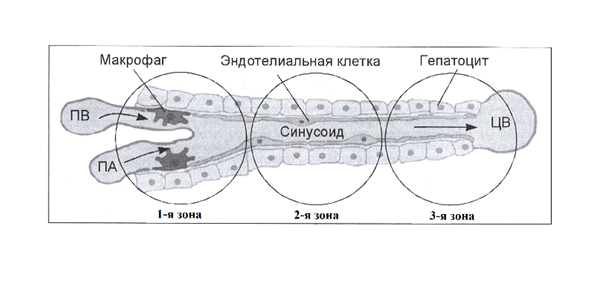
Рис. 7. В 3-ей зоне синусоида содержится наибольшее количество гликогена и наблюдается высокая активность гликогенсинтетазы и гликогенфосфорилазы. В 1-ой зоне преобладает активность ферментов глюконеогенеза [14].
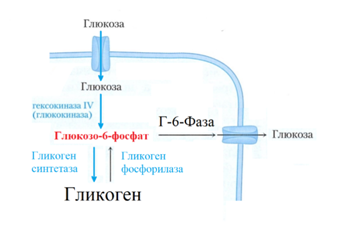
Рис. 8. Под действием гликогенсинтетазы Г-6-Ф превращается в гликоген. Обратное превращение гликогена в глюкозу осуществляется под действием гликогенфосфорилазы и Г-6-Фазы [8].
Наличие депонированного гликогена и специфических ферментов для его синтеза и утилизации позволяют выделить зону депонирования гликогена (рис. 7, 8). Контроль в системе «депонирование – расходование» осуществляется гормонами [8].
В тоже время, очевидно, что глюконеогенез совершается непрерывно, и лактат образуется постоянно, поскольку эритроциты постоянно утилизируют в процессе гликолиза около 36 г глюкозы в сутки. Глюколиз в эритроцитах не может иметь перерыва как не может быть перерыва в снабжении организма кислородом. В эритроцитах отсутствуют митохондрии и глюкоза метаболизируется путем гликолиза при этом конечным продуктом является лактат, который в печени восстанавливается до Г-6-Ф, а затем дефосфорилируется до высвобождения свободной глюкозы (рис. 9) [8].
Для глюконеогенеза к лактату эритроцитов добавляется лактат и пируват из АК мышечной ткани и глицерин. Белые мышечные волокна не имеют резерва кослорода, поэтому метаболизируют глюкозу до лактата. В условиях физических нагрузок мышечные аминокислоты аланин и глутамин окисляются до пирувата, который в печени становится источником глюконеогенеза. Триглицериды пищи, в ходе транспорта от кишечника до жирового депо и мышц дважды подвергаются гидролизу, в процессе которого освобождается глицерин, который доставляется в печень и становится источником глюконеогенеза. Глюконеогенез лактата, глицерина и пирувата даёт 80 г глюкозы в сутки [8].
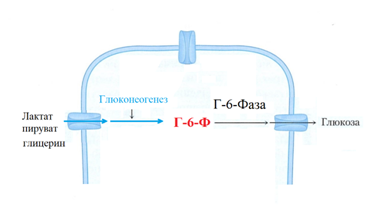
Рис. 9. Глюконеогенез метаболизирует лактат, пируват и глицерин. Очевидно, что глюконеогенез в печени не прекращается во время приема пищи [8].
Таким образом, глюкоза в форме гликогена запасается в печени и в скелетной мускулатуре. Максимальный запас гликогена печени ограничен 150 граммами, мышцы тела максимально запасают 300 г гликогена [8].
Мышцы потребляют много глюкозы и переводят ее в гликоген, но в кровь глюкозу не отдают, а используют на собственные нужды энергообеспечения. Такая особенность метаболизма глюкозы определяется тем, что в составе миоцитов отсутствует Г-6-Фаза и мышцы не могут переводить Г-6-Ф в глюкозу (рис. 10) [8].
Расходы глюкозы в организме взрослого человека составляют 10 г/час, около 65 % глюкозы потребляет головной мозг и эритроциты. На долю печени и скелетной мускулатуры остается около 35 % глюкозы [1,11]. Система гомеостаза регулирует концентрацию глюкозы крови, пищевая глюкоза депонируется в форме гликогена, однако система гомеостаза не регулирует скорость и объемы поступления пищи, но обязана справляться с ее излишками. Более 450 г гликогена в депо печени и миоцитов не входит, а других мест хранения просто нет, поэтому система гомеостаза превращает излишки глюкозы в ЖК, которые этерифицируются в адипоцитах в триглицериды (триацилглицерины) [11].
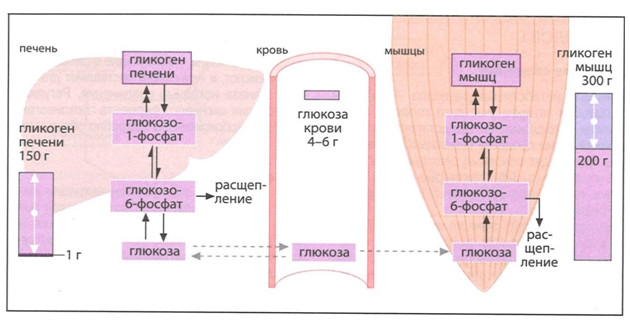
Рис. 10. Гликоген мышц используется как энергетический резерв и не участвует в регуляции уровня глюкозы крови, эту функцию выполняет печень [12].
Депонирование и катаболизм триглицеридов (ТГ)
Транспорт пищевых триацилглицеринов (ТГ) осуществляется хиломикронами (ХМ), которые синтезируются в эпителии тонкого кишечника и минуя печень, по лимфатической системе поступают в кровь, достигают жировых клеток, мышц тела и сердечной мышцы (рис. 11,12) [12].
В капиллярах мышечной и жировой ткани белок апоС-II хиломикронов активирует липопротеинлипазу, расположенную на поверхности эндотелиальных клеток, которая гидролизует ТГ на глицерин и жирные кислоты (ЖК). ЖК утилизируются в сердечной мышце и в миоцитах поперечно-полосатой мускулатуры, а в жировой ткани этерифицируются в ТГ и депонируются в адипоцитах. Глицерин переносится в печень. Скорость метаболизма ХМ составляет 10-15 минут полувыведения из крови. После отдачи ТГ размеры ХМ уменьшаются, сохраняется лишь 15 % исходной массы, эти остатки ХМ называются ремнанты ХМ (рис. 12). Печеночные клетки связывают через белок апоЕ-ремнанты хиломикронов и утилизируют их [5,7,8,9].
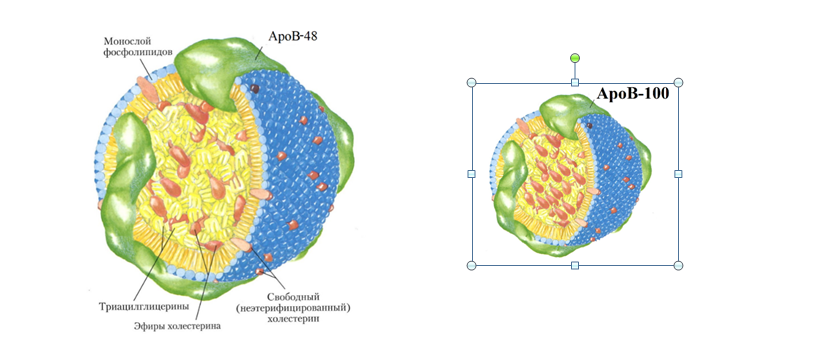
Рис.11. А-молекулярная структура липопротеида хиломикрона (ApoВ-48) (слева).
В-липопротеид очень низкой плотности (ApoВ-100) (справа) [1]
Дальнейшее распределение липидов находится под контролем печени. Перенос липидов осуществляется липопротеидами, которые по строению аналогичны ХМ, но различаются размерами, гидратированной плотностью, составом ядра и наличием апобелков. В печени синтезируются липопротеиды очень низкой плотности (ЛПОНП). Сборка ЛПОНП начинается с синтеза белка апоВ-100 поскольку возможности синтеза липопротеидов определены его наличием. ЛПОНП разгружают печень от излишков ТГ и свободных ЖК, которые транспортируются в адипоциты и мышцы [1].
Небольшое количество ЖК в печени из ремнантов ХМ подвержены окислению для покрытия энергетических потребностей гепатоцитов. При регулярном и обильном питании ТГ адипоцитов остаются мало востребованными, триглицеридовый цикл обеспечивает постоянный уровень ЖК в плазме крови, достаточный для непрерывной работы сердца, однако второй главный потребитель триглицеридов – скелетные миоциты, при малой активности обходятся запасами гликогена [1].
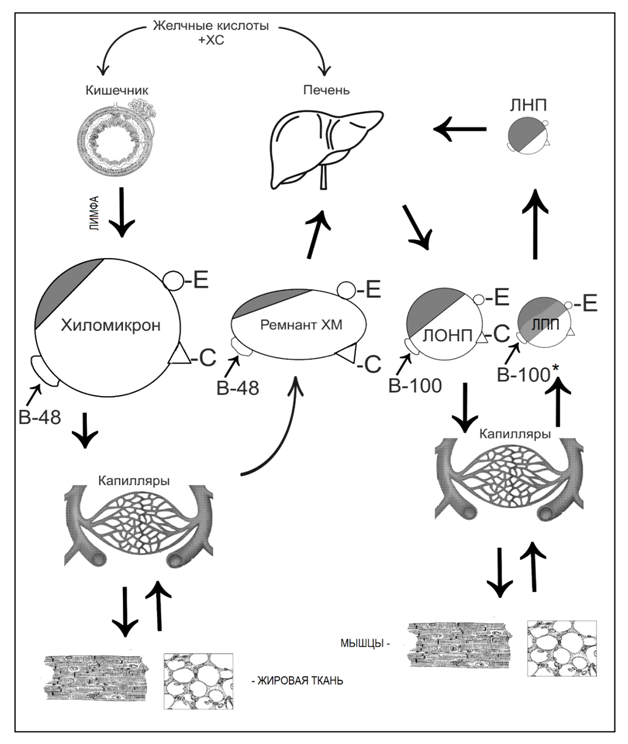
Рис. 12. Пути транспорта ХМ и ЛП разной плотности по лимфатической и кровеносной системе [8].
Условные обозначения: чёрная часть – доля холестерина, неокрашенная часть – доля триглециринов
Депонированные ТГ используются организмом в ходе липолиза, в результате которого освобождаются ЖК, последние связываются с альбумином и циркулируют в плазме крови. Липолиз контролируется гормонами и состоянием окружающей среды. Липолиз усиливается под действием адреналина, глюкагона, тироксина, гормона роста, глюкокортикоидов, АКТГ. Важно отметить, что усиление липолиза происходит в условиях стресса, физических нагрузок, голодания и охлаждения (рис. 13.) [11].
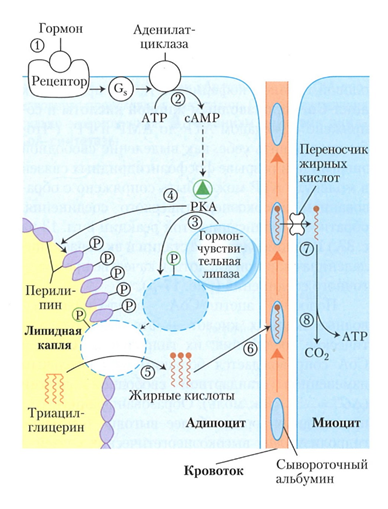
Рис. 13. Под действием гормонов активируется аденилатциклаза с образованием сАМФ, который активирует протеинкиназу А (ПКА). ПКА фосфорилирует гормон-чувствительную липазу и перелипин поверхности липидной капли. ТГ липидной капли гидролизуется под действием липазы на ЖК, которая поступает в кровь [1].
Во время ночного перерыва между приёмами пищи, при внезапных физических нагрузках и при голодании между адипоцитами и печенью возникает загадочный триацилглицериновый цикл [7]. Ночью под действием глюкагона, во время внезапных физических нагрузок под действием адреналина, молекулы ТГ в адипоцитах гидролизуются на ЖК и глицерин, попадают в кровь, далее в печень, где снова этерифицируются в ТГ. ТГ печени транспортируются обратно в жировую ткань, при этом 75 % ЖК, высвобождаемых из адипоцитов этерифицируются в ТГ, а не используются в метаболизме (рис. 14) Такое соотношение циркулирующих и катаболизируемых ЖК сохраняются даже в условиях голодания [11].
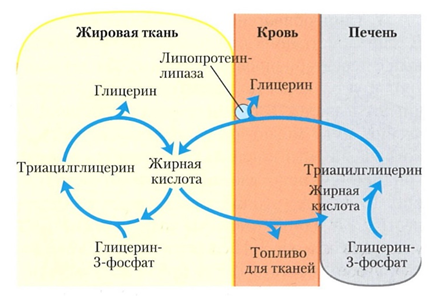
Рис. 14. В триглицеридовом цикле многократно происходят переход из полимерного состояния триглицеридов в мономерное состояние ЖК и обратный процесс, полимеризации ТГ [1]
В ходе окисления ЖК в печени образуется ацетил-КоА. Излишки ацетил-КоА превращаются в кетоновые тела: ацетоацетат и ß-гидроксибутирата поступают в кровь, разносятся в разные органы в клетках которых кетоны под действием тиолазы возвращаются в форму ацетил-КоА доступную для цикла лимонной кислоты (рис.15) [11].
Примечательно, что в печени отсутствует тиолаза гидролизующая кетоны до ацетил-КоА, поэтому сама печень кетоны не использует.
В условиях полного голодания кетоновые тела становятся единственным источником энергии не только для клеток сердечной и скелетной мускулатуры, для клеток головного мозга и других тканей. Нейроны головного мозга в условиях голодания приспосабливаются к окислению ацето-ацетата и ß-гидроксибутирата. Кетоны являются удобной формой переноса двух упакованных молекул ацетил-КоА, из печени в ткани организма [8].
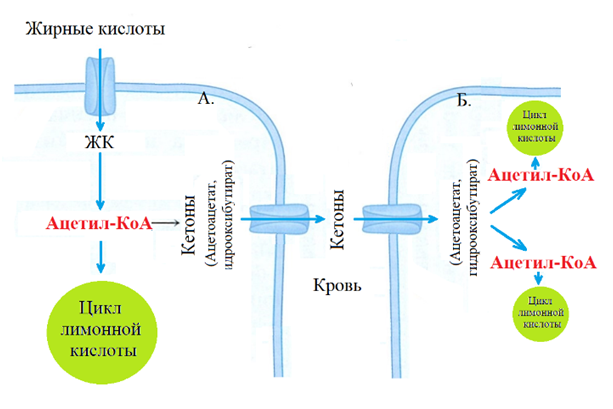
Рис. 15. ЖК в гепатоцитах окисляются до ацетил-КоА, который используется печенью для собственной энергетики. Излишки ацетил-КоА превращаются в кетоновые тела, поступают в кровь и разносятся разным клеткам [8].
А - гепатоцит, Б - кардиомиоцит, миоцит скелетной мускулатуры.
Главным энергетическим источником для сердечной мышцы являются жирные кислоты плазмы крови. Постоянный потребитель ЖК – сердечная мышца обеспечена постоянным уровнем ЖК в крови, даже в условиях голодания уровень ЖК в крови остаётся постоянным (рис. 16) [11].
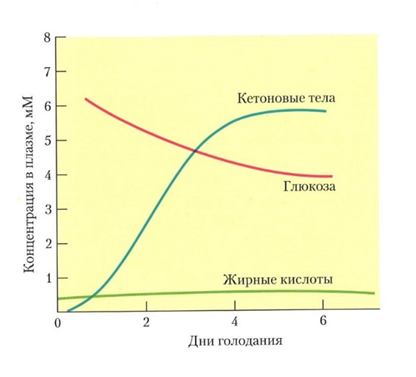
Рис. 16. Даже в условиях голодания уровень жирных кислот в крови остаётся постоянным [1,12].
Депонирование и катаболизм аминокислот
У человека весом 70 кг содержится 11 кг белка, 40 % весового содержания которого приходится на долю актина, миозина, тропоколлагена и коллагена – белков скелетной мускулатуры [8].
АК в организме находятся в связанном состоянии. Поэтому АК, необходимые для биогенеза и глюконеогенеза, могут быть получены в результате изъятия из структурных белков. Механизм, при помощи которого АК освобождаются в миоцитах, переносятся в печень и заново восстанавливаются в миоцитах, остается загадочным, но способность выделять АК в кровоток, по мере потребности, отводит скелетной мускулатуре роль депо АК. Установлено, что 60 % пищевых АК – валин, лейцин и изолейцин целенаправленно и сразу после приема пищи поступают в мышцы. В то же время аланин и глутамин составляют более 50 % от общего количества АК, выделяющихся из миоцитов для глюконеогенеза в печени (рис. 17, 19) [8].
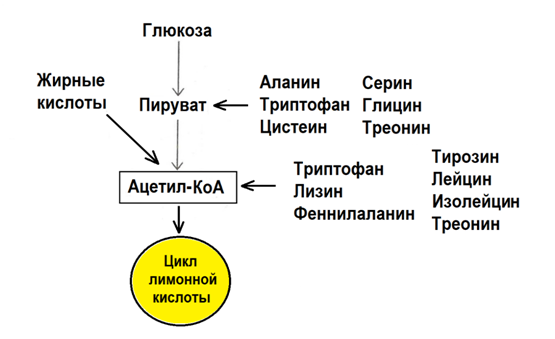
Рис. 17. Шесть аминокислот распадаются до пирувата, а семь – до ацетил-КоА [8]
Многие АК обладают индивидуальной специфичностью по способности участвовать в катаболизме. В частности, специфичность АК проявляется в том, что шесть АК распадается до пирувата, а семь до ацетил-КоА (рис. 17). АК, которые распадаются с образованием пирувата, могут быть использованы в глюконеогенезе для синтеза глюкозы и гликогена, либо образовывать ацетил-КоА для синтеза ЖК или для окисления в цикле лимонной кислоты. Семь АК распадаются до ацетил-КоА и могут образовывать кетоновые тела (рис. 17). При этом пять АК – триптофан, фенилаланин, треонин и изолейцин могут превращаться и в глюкозу, и в кетоновые тела. Однозначно кетогенными являются только лизин и лейцин [7,8].
Три разветвленные АК – валин, лейцин и изолейцин не могут катаболизировать в печени, они окисляются в мышцах, жировой ткани печени и мозге. В печени отсутствует фермент аминотрансфераза, который превращает разветвленные АК в кетокислоты. В перечисленных органах фермент присутствует, поэтому разветвленные АК претерпевают деградацию только во внепеченочных тканях. Практически все АК могут участвовать в цикле трикарбоновых кислот [11].
Важной особенностью скелетной мускулатуры является наличие волокон двух типов. Различают волокна первого и второго типа, соответственно красные и белые волокна. Красные волокна – аэробы, способны выполнять длительную работу за счет окисления ЖК. Белые способны выполнять быстрые, сильные сокращения за счет анаэробного гликолиза, в ходе окисления гликогена, который превращается в лактат (рис. 10,18,19) [11].
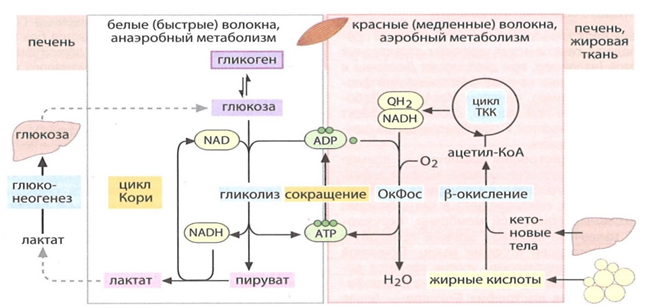
Рис. 18. Красные волокна метаболизируют ЖК в процессе β-окисления и окислительного фосфорилирования. Резерв кислорода обеспечивает белок миоглобин, который получает кислород от гемоглобина. Белые волокна не имеют резерва кислорода, поэтому метаботлизируют гликоген через глюкозо-6-фосфат, пируват до лактата. Лактат через кровь попадает в печень и в ходе глюконеогенеза превращается в глюкозу [12].
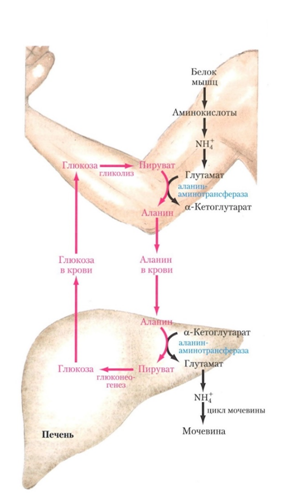
Рис. 19. Лактат образуется постоянно в результате гликолиза в эритроцитах и гликолиза в скелетной мускулатуре. Лактат переносится в печень где в ходе глюкогенеза восстанавливанется в Г-6-Ф. Г-6-Ф дефосфорелируется до высвобождения свободной глюкозы, которая снова исполь-зуется мышцами, эритроцитами и нейронами головного мозга [6].
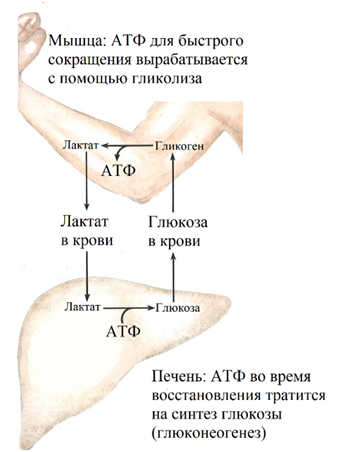
Рис. 20. При физических нагрузках шесть аминокислот могут превращаться в пируват, который используется для синтеза глюкозы. Преимущественно расходуется аминокислота аланин, поэтому глюконеогенез с участием аланина называют аланиновым циклом, в отличии от цикла Кори, при котором пируват получается из лактата [6]
Лактат переносится в печень, где в ходе глюконеогенеза восстанавливается в Г-6-Ф. Г-6-Ф фосфорилируется до свободной глюкозы и высвобождается в кровь (рис. 9, 19). При высоких физических нагрузках и использовании мышечного гликогена, шесть аминокислот (рис. 17) и особенно аланин превращаются в пируват, который используется для синтеза глюкозы (рис. 20) [11].
Таким образом, скелетная мускулатура депонирует гликоген и белки. Гликоген используется мышцами индивидуально для сокращения белых волокон, при этом в процессе гликолиза используется только часть энергетического потенциала гликогена и АК. Не использованная часть гликогена и аминокислот поступает в печень и превращается в глюкозу.
Скелетная мускулатура является постоянным источником гликогенных и кетогенных аминокислот, восполняя потребности в глюкозе и в кетонах при голодании и нерегулярном питании [11].
Заключение
Пищевые вещества депонируются только в форме гликогена, триглицеридов и белков, и уже из депо расходуются на основной обмен и физическую активность. Исключением являются эритроциты крови и нейроны головного мозга, которые могут утилизировать пищевую глюкозу во время её транспорта по кровеносной системе. Все остальные клеточные структуры получают клеточную органику из депо.
Доступными для клеточного метаболизма являются глюкоза, аминокислоты и жирные кислоты, которые в процессе клеточного окисления превращаются в ацетил Ко-А. При этом ацетил Ко-А может быть использован как для синтеза жирных кислот, так и для производства АТФ. Наблюдается выраженная органоспецифичность катоболизма пищевой органики (смотрите далее).
Список литературы
1. Нельсон Д., Кокс М. Основы биохимии Ленинджера. в 3 т. Т. 2. Биоэнергетика и метаболизм. М.:Лаборатория знаний; 2020:636 [Nelson D, Cox M. Lehninger's Fundamentals of Biochemistry. in 3 volumes. T. 2. Bioenergetics and metabolism. Moscow: Knowledge Lab; 2022:636 (In Russian)].
2. Вельков В.В. Мертвая петля свободных жирных кислот. Химия и жизнь. 2009;(2):46-49 [Velkov V.V. Dead loop of free fatty acids. Chemistry and life. 2009;(2):46-49 (In Russian)]. URL: https://hij.ru/read/4753 [дата доступа: 26.10.2023].
3. Global Obesity Observatory. URL: https://www.worldobesity.org/rankings [accessed: 26.10.2023].
4. Nanditha A., Ma R.C., Ramachandran A. et al. Diabetes in Asia and the Pacific: Implications for the Global Epidemic. Diabetes Care. 2016;39(3):472-485. https://doi.org/10.2337/dc15-1536
5. Ньюссбаум Р.Л., Мак-Иннес Р.Р., Виллард Х.В. Медицинская генетика. М.:ГЭОТАР-Медик;2010:620 [Newssbaum R.L., McInnes R.R., Willard H.V. Medical genetics. M.: GEOTAR-Medic; 2010:620 (In Russian)].
6. Нельсон Д., Кокс М. Основы биохимии Ленинджера. в 3 т. Т. 1. Основы биохимии, строение и катализ. М.:Лаборатория знаний; 2020:749 [Nelson D, Cox M. Lehninger's Fundamentals of Biochemistry. in 3 volumes. T. 1. Fundamentals of biochemistry, structure and catalysis. Moscow: Knowledge Lab; 2020:749 (In Russian)].
7. Физиология эндокринной системы. Под ред. Гриффина Дж. и Охеды С. М.: БИНОМ, Лаборатория знаний; 2008:496 [Physiology of the endocrine system. Ed. Griffin J. and Ojeda S. M.: BINOM, Knowledge Lab; 2008:496 (In Russian)].
8. Майборода А.А. Молекулярные основы липидологии. Иркутск: ИНЦХТ; 2023:119 [Mayboroda A.A. Molecular basis of lipidology. Irkutsk: ISCCT; 2023:119 (In Russian)].
9. Эллиот В., Эллиот Д., Биохимия и молекулярная биология. М.: Издательство НИИ биомедицинской химии РАМН; 1999:372 [Elliot W., Elliot D., Biochemistry and Molecular Biology. M.: Publishing house of the Research Institute of Biomedical Chemistry of the Russian Academy of Medical Sciences; 1999:372 (In Russian)].
10. Sabine J.R. Cholesterol. New York:Marcel Dekker; 1977:489.
11. Альбертс Б., Хопкин К., Дагонсон А. и др. Основы молекулярной биологии клетки. М.:Лаборатория знаний; 2023:796 [Alberts B., Hopkin K., Dagonson A. et al. Fundamentals of molecular biology of the cell. M.: Laboratory of knowledge; 2023:796 (In Russian)].
12. Кольман Я., Рём К.-Г. Наглядная биохимия. М.:Лаборатория знаний; 2019:509 [Koolman J., Roehm K.-H.. Visual biochemistry. M.: Laboratory of Knowledge; 2019:509 (In Russian)].
13. Майборода А.А. Структурно-функциональная организация биологической системы. Сибирский медицинский журнал.(Иркутск). 2006;(7):95-97 [Mayboroda A.A. Structural and functional organization of a biological system. Siberian medical journal (Irkutsk). 2006;(7):95-97 (In Russian)]. URL: https://cyberleninka.ru/article/n/strukturno-funktsionalnaya-organizatsiya-biologicheskoy-sistemy [дата доступа: 26.10.2023].
14. Усынин И.Ф., Панин Л.Е. Механизмы формирования фенотипической гетерогенности гепатоцитов. Биохимия. 2008;73(4):453-468 [Usynin I.F., Panin L.E. Mechanisms of formation of phenotypic heterogeneity of hepatocytes. Biochemistry. 2008;73(4):453-468 (In Russian)]. URL: https://biochemistrymoscow.com/ru/archive/2008/73-04-0453 [дата доступа: 26.10.2023]
Об авторе
Аскольд Александрович МайбородаРоссия
д.б.н., профессор, заведующий кафедрой медицинской биологии,
почетный ректор ИГМУ
Рецензия
Для цитирования:
Майборода А.А. ПИЩЕВОЙ МЕТАБОЛИЗМ И ОЖИРЕНИЕ. ЛЕКЦИЯ 1 (ПОТРЕБЛЕНИЕ И ДЕПОНИРОВАНИЕ). Байкальский медицинский журнал. 2023;2(4):72-84. https://doi.org/10.57256/2949-0715-2023-4-72-84
For citation:
Mayboroda A.A. FOOD METABOLISM AND OBESITY. REPORT 1 (CONSUMPTION AND DEPOSITION). Baikal Medical Journal. 2023;2(4):72-84. (In Russ.) https://doi.org/10.57256/2949-0715-2023-4-72-84
















