Перейти к:
КОАГУЛЯЦИОННЫЙ ГЕМОСТАЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА
https://doi.org/10.57256/2949-0715-2025-4-2-32-52
Аннотация
Актуальность. Система гемостаза – сложный многоуровневый механизм, который с одной стороны, предотваращает потерю крови при повреждении сосуда, с другой – поддреживает кровь в жидком состоянии, предотвращая избыточное образование тромбов. Реализуется при участии клеток крови, эндотелиоцитов и других клеток, а также несколькими последовательно и взаимоактивируемыми ферментными системами. Выделяют два вида гемостаза: первичный и вторичный. В результате активации первичного гемостаза образуется тромбоцитарный тромб, вторичного – фибриновый сгусток. Нарушения гемостаза приводят или к кровотечениям или тромбозу, что является одной из актуальных причин смертности и заболеваемости в мире. Поэтому знание работы этой системы является важной задачей при обучении в медицинских вузах.
Цель. Рассмотреть современные представления о механизмах формирования фибринового сгустка в норме и патологии, привести скрининговые тесты для определения патологии коагуляционного гемостаза.
Результаты. В лекции рассмотерна последовательность активации факторов коагуляционного гемостаза с позиции клеточной теории. Отдельно приведено описание и характеристика большинства участников процесса коагуляционного гемостаза. Описаны наиболее распространенные причины, механизмы и проявления гипо- и гиперкоагуцяции. В конце описаны наиболее распростараненные скриннинговые тесты анализа состояния коагуляционного гемостаза.
Заключение. Согласно клеточной модели, гемостаз происходит в четыре перекрывающиеся фазы (инициация, усиление распространение и терминация) и происходит на различных клеточных поверхностях. В частности, коагуляция инициируется в клетках, экспрессирующих тканевой фактор, усиливается в активирующих тромбоцитах и распространяется на фосфолипидной поверхности полностью активированных тромбоцитов. Гемостаз включает в себя сложные биохимические механизмы и взаимодействия между сосудистым эндотелием, факторами свертывания крови и клеточными (в основном тромбоцитами) компонентами крови.
Ключевые слова
Для цитирования:
Гуцол Л.О., Егорова И.Э., Семинский И.Ж., Гузовская Е.В., Серебренникова С.Н., Дмитриева Л.А. КОАГУЛЯЦИОННЫЙ ГЕМОСТАЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА. Байкальский медицинский журнал. 2025;4(2):32-52. https://doi.org/10.57256/2949-0715-2025-4-2-32-52
For citation:
Gutsol L.O., Egorova I.E., Seminsky I.Zh., Guzovskaiia E.V., Serebrennikova S.N., Dmitrieva L. COAGULATION HEMOSTASIS: MODERN VIEW, PATHOLOGY, DIAGNOSTICS. Baikal Medical Journal. 2025;4(2):32-52. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-2-32-52
Введение
Способность организма контролировать кровопотерю после повреждения сосудов имеет важное значение для выживания организма и обеспечивается системой гемостаза, задачей которой является формирование тромба с последующим его лизисом.
Таким образом, гемостаз – это совокупность морфофункциональных механизмов, которая обеспечивает:
- быструю остановку кровотечения и предотвращение кровопотери при повреждении кровеносных сосудов – тромбоцитарный и коагуляционный гемостаз (свертывающая система),
- удаление тромба, растворение фибрина и восстановление кровотока после восстановления поврежденной стенки сосуда (фибринолиз).
- поддержание жидкого состояния крови внутри сосудов (антикоагулянтная система).
Как для коагуляции, так и для поддержания жидкого состояния крови требуются многочисленные факторы (белковой и небелковой природы), составляющие систему гемостаза (табл. 1). Синтез белковых факторов осуществляется в гепатоцитах, мегакариоцитах, эндотелиоцитах, фибробластах и моноцитах [1,2].
Система свертывания состоит из ферментов, неферментативных белковых кофакторов и ингибиторов свертывания, скоординированная работа которых приводит к формированию фермента тромбина, обеспечивающего переход фибриногена в фибрин [1,2].
В процессе активации ферментов каскада коагуляции выделяют три основных механизма: ограниченный протеолиз, взаимодействие с белками-активаторами и взаимодействие с модифицированными клеточными мембранами.
Активация ограниченным протеолизом. Все ферменты прокоагулянтного пути являются сериновыми протеазами, синтезируются преимущественно в печени в виде неактивных проферментов и в такой форме циркулируют в крови. В процессе реализации тромбогенного сигнала проферменты (факторы II, VII, IX, X и XI) ограниченным протеолизом превращаются в активные ферменты.
Активация белками-активаторами. Тканевой фактор (ТФ), фактор Vа, фактор VIIIа имеют центры связывания с мембранными фосфолипидами и ферментами VIIа, IXа и Xа. Присоединение к этим ферментам белков-активаторов приводит к конформационной перестройке белковых молекул и повышению их активности.
Взаимодействие ферментных комплексов с модифицированными клеточными мембранами происходит с участием ионов Са2+. Процесс образования тромба должен быть ограничен участком повреждения сосудистой стенки. Такое ограничение обеспечивают несколько механизмов и среди них – наличие прокоагулянтных фосфолипидов на поврехности поврежденных клеток и активированных тромбоцитов. Проферменты (II, VII, IX, X) содержат остатки γ-карбоксиглутаминовой кислоты, через которые в присутствии Са2+связываются с отрицательно заряженными фосфолипидами клеточных мембран. В отсутствие ионов Са2+ кровь не свертывается [1,2,3,4].
Таблица 1. Факторы свертывания крови
Table 1. Blood coagulation factors
Фактор | Функции
|
Фактор I – фибриноген | Фибриноген – большой многокомпонентный белок, является предшественником мономеров (и полимеров) фибрина. Пространственная структура молекулы фибриногена представляет собой центральный Е-домен и 2 периферических D-домена и фибринопептиды, которые закрывают комплементарные участки в фибриногене, не позволяя ему взаимодействовать с другими молекулами фибриногена и полимеризоваться. Синтез фибриногена не зависит от витамина К, происходит в печени и в клетках ретикуло-эндотелиальной системы. Некоторое количество фибриногена синтезируется в мегакариоцитах и в тромбоцитах. Превращение фибриногена в фибрин происходит под влиянием тромбина. Также фибриноген принимает участие в агрегации тромбоцитов и необходим для репарации тканей. Является белком острой фазы. Синтез фибриногена стимулируется гормонами (инсулин, прогестерон), жирными кислотами и продуктами деградации фибриногена. Уровень фибриногена в плазме повышен у курильщиков, больных сахарным диабетом. С повышением уровня фибриногена увеличивается риск сердечно-сосудистых заболеваний. У женщин уровень фибриногена выше, чем у мужчин, и у них более заметно его увеличение с возрастом. |
II / IIа – протромбин/ тромбин | Протромбин – синтезируется в печени при участии витамина К, является предшественником сериновой протеазы – тромбина. Функции тромбина в гемостазе разнообразны:1) в зоне коагуляции тромбин присутствует в высоких концентрациях и способствует тромбообразованию: - превращает фибриноген в фибрин-мономеры, - активирует фактор XIII, - активирует стадию амплификациии (усиления свертывания крови), - активирует тромбоциты и свызвает дегрануляцию тромбоцитов, - в комплексе с тромбомодулином активирует ингибитор фибринолиза TAFI (thrombin activatable fibrinolysis inhibitor), - является хемоаттрактантом для лейкоцитов; 2) вне зоны коагуляции (в области неповрежденного эндотелия) концентрация тромбина небольшая и он выступает как антикоагулянт, дезагрегант и стимулятор фибринолиза: - в комплексе с тромбомодулином активирует антикоагулянт протеин С, - стимулирует секрецию из эндотелиальных клеток вазодилататоров (простациклина и оксида азота) и тканевого активатора плазминогена (tPA). |
III – тканевой фактор (тканевой тромбопластин, ТФ) | Представляет собой комплекс, состоящий из белка и фосфатидилсерина. ТФ является компонентом мембран ряда клеток (центральной нервной системы, эпидермиса, эпителия, выстилающего слизистые оболочки органов, легких, плаценты; моноциты и макрофаги экспрессируют ТФ после стимуляции воспалительными цитокинами; обнаруживается в атеросклеротических бляшках), в норме не контактирующих с плазмой крови. Белковая часть ТФ (апопротеин III) экспонирована на поверхности этих клеток и связана с фосфатидилсерином плазматических мембран. Появление апопротеина III на поверхности клеток, соприкасающихся с кровью (эндотелиальных и моноцитов), происходит только при определённых условиях: при повреждении сосуда и/или нарушении нормальной асимметрии их плазматических мембран. ТФ не нуждается в протеолитической активации [5]. Он подвергается воздействию текущей крови во время травмы или воспаления, связывается с фактором VIIa и инициирует коагуляцию. |
IV ионы кальция (Са2+)
| Участвует в образовании комплексов, входящих в состав теназы и протромбиназы. Необходим для агрегации тромбоцитов, реакции высвобождения, ретракции и стабилизации фибрина. Эффекты ионов Са2+: 1. необходимы для изменения конформации факторов свертывания, после чего последние способны принимать участие в ферментативных реакциях гемостаза; 2. являются связующими мостиками между факторами свертывания и клеточными мембранами. При этом ионы Са2+, с одной стороны, присоединяются к головкам фосфатидилсерина, а с другой – соединяются с остатками γ-карбоксиглутаминовой кислоты, которая входит в состав ряда факторов свертывания крови (V, VIII, IX и др.). За счет таких кальциевых мостиков происходит первоначальное ориентирование факторов свертывания крови на фосфолипидной поверхности, и в результате изменения конформации белковых молекул открываются активные центры; 3. участвуют в образовании кластеров на мембране активированных тромбоцитов; 4. способствуют стабилизации фибринового сгустка; 5. активация тромбоцитов. |
V/ Vа – проакцелерин/ акцелерин | Гликопротеид, который синтезируется гепатоцитами и мегакариоцитами, его синтез не зависит от витамина K. Циркулирует в крови как неактивный кофактор. Активируется тромбином. Является белком-активатором Xa и участвует в превращении протромбина в тромбин в присутствии кальция и фосфолипидов. Фактор Va инактивируется антикоагулянтым комплексом «протеин С+протеин S+Ca2+». Принимает участие как в коагуляции, так и в антикоагуляции: – тромбин и фактор Xa, которые образуются в местах повреждения сосуда, преобразуют фактор V в фактор Va, – протеин С, который образуется в неповрежденных сосудах, преобразует фактор V в антикоагулянтный фактор Vac, который стимулирует деградацию фактора VIIIa. Таким образом, протеолитическая модификация циркулирующего фактора V определяет, будет ли фактор V преобразован в прокоагулянтный фактор Va или в антикоагулянтный фактор Vac. |
VII / VIIа Проконвертин / конвертин | Является К-витамин-зависимым фактором. Синтезируется в печени. Активируется после связывания с ТФ и затем активирует фактор X и, возможно, фактор IX. |
VIII/ VIIIа – антигемофильный глобулин А | Синтезируется в печени, селезёнке, лимфоцитах. Является белком-кофактором в комплексе фактор «IXa-VIIIa-Ca2+-фосфолипид», который активирует фактор Х. После секреции сразу связывается фактором фон Виллебранда (vWF) и циркулирует в комплексе с ним (vWF препятствует разрушению фактора VIII). После активации тромбином фактора VIII данный комплекс разрушается, позволяя фактору vWF участвовать в процессах адгезии и агрегации тромбоцитов. Инактивируется комплексом «протеин С+протеин S+Ca2+» (как и фактор Va). |
IX / IXа – фактор Кристмаса, антигемофильный глобулин В | Является К-витамин-зависимым ферментом. Синтезируется в печени. Активируется фактором XIa, тромбином и фактором VIIa до фактора IXa, который активирует фактор Х. |
Х / Ха – фактор Стюарта-Прауэра | Является К-витамин-зависимым ферментом, образуется в печени, входит в состав протромбиназы и расщепляет протромбин до тромбина. |
XI / XIа – Плазменный предшественник тромбопластина | Профермент. Образуется в печени. Активируется преимущественно тромбином, и относительно медленно фактором XIIа, до фактора XIa, который активирует фактор IX. |
XII / XIIa – Фактор Хагемана | Протеаза, которая синтезируется преимущественно в печени. Активируется после контакта с отрицательно заряженными поверхностями (коллагеном, протеогликанами, гликопротеинами (гепарин, гиалуроновая кислота и дерматансульфат), некоторыми воспалительными медиаторами и бактериальными токсинами. Согласно клеточной биологической модели коагуляции, внутренний путь «XIIа-XIа» служит только в качестве петли усиления коагуляции, инициированной внешним путем ТФ. Активирует фактор XI, преобразует плазменный прекалликреин в калликреин, который реципрокно активирует фактор XII и высвобождает брадикинин из высокомолекулярного кининогена. Основной эффект фактора XIIa – инициация фибринолиза путем опосредованной калликреином активации урокиназы. Также XIIa может активировать систему комплемента по классическому пути [2,6]. |
XIII / XIIIа – фибринстабилизи-рующий фактор | Фибринстабилизирующий фактор относится к семейству ферментов трансглутаминаз. Он синтезируется в печени, фибробластах, мегакариоцитах. В плазме крови большая часть неактивного фактора ХIII связана с фибриногеном. Его активация происходит при помощи тромбина путем ограниченного протеолиза из неактивного предшественника. Как и большинство других ферментов, фактор XIIIа выполняет в гемостазе несколько функций: - стабилизирует фибриновый сгусток путем образования ковалентных связей между γ-цепями мономеров фибрина, - прикрепляет фибриновый сгусток к фибронектину внеклеточного матрикса, - участвует в связывании α2-антиплазмина с фибрином, что способствует предотвращению преждевременного лизиса фибринового сгустка, - необходим тромбоцитам для полимеризации актина, миозина и других белков цитоскелета, используемых при ретракции фибринового сгустка. |
Прокоагуляционные фосфолипиды | Отрицательно заряженные фосфолипиды (в основном, фосфатидилсерин) присутствуют на поверхности активированных тромбоцитов, эндотелиальных клеток и клеток других тканей. На внешней стороне плазматической мембраны, контрактирующей с кровью, преобладают в основном фосфатидилхолин и сфингомиелин. Молекулы этих фосфолипидов электронейтральны – в них нет преобладания одного из зарядов. Фосфатидилсерин расположен преимущественно во внутреннем слое мембраны. Головка этого фосфолипида несет два отрицательных заряда и один положительный, т. е. на ней преобладает отрицательный заряд. Инициация свертывания крови может наступить лишь тогда, когда эти фосфолипиды появятся на наружной поверхности мембраны. Отрицательно заряженные фосфолипиды появляются на мембране разрушающихся клеток, активированных тромбоцитов, на мембране высвобождающихся из тромбоцитов α-гранул. Кроме того, анионные фосфолипиды появляются на микровезикулах апоптозирующих клеток. После увеличения на поверхности клеточной мембраны концентрации отрицательно заряженных фосфолипидов, в этих местах образуются специальные кластеры – активные зоны, к которыми прикрепляются факторы свертывания и формируются внешняя и внутренняя теназы и протромбиназа. |
Тромбостенин | Актомиозин тромбоцитов, обладающий АТФ-азной активностью. Тромбостенин участвует в ретракции сгустка, активации и агрегации тромбоцитов. |
Фактор Виллебранда (vWF) | Гликопротеин плазмы крови. Выделяют две основные функции vWF в гемостазе. В кровотоке vWF связывается и препятствует разрушению фактора VIII. Тромбин расщепляет сайт связывания фактора VIII с vWF, способствуя высвобождению (активации) фактора VIIIa. При реализации тромбоцитарно-сосудистого гемостаза vWF опосредует адгезию тромбоцитов к поврежденной сосудистой стенке. |
Фибронектин (ФН) | Гликопротеин, принимает непосредственное участие в клеточных взаимодействиях и играет важную роль в таких процессах, как клеточная адгезия, пролиферация, клеточная подвижность, дифференцировка, опсонизация и апоптоз. У позвоночных животных присутствует два типа ФН: 1) растворимый ФН плазмы (ранее называемый холодонерастворимым глобулином), который вырабатывается в печени гепатоцитами; 2) нерастворимый клеточный ФН, который является основным компонентом внеклеточного матрикса. Синтезируется фибробластами, хондроцитами, миоцитами и синовиальными клетками. |
Теназы | Внешняя теназа – комплекс «TФ-VIIа-Ca2+» активирует фактор X в стадию инициации. Внутрення теназа «IXa-VIIIa-Ca2+» активирует образвование фактора X в стадию пропагации. |
Высокомолекуляр-ный кининоген (ВМК, фактор Фитцжеральда-Флюже) | Образуется во многих тканях. Активируется калликреином. Является кофактором фактора XII, также помогает фиксироваться на поврежденной поверхности прекалликреину и XI фактору. Необходимо иметь в виду, что согласно новой клеточной теории эти белки относятся к системе фибринолиза. |
Прекалликреин / Калликреин, фактор Флетчера | Прекалликреин – предшественник калликреина, является сериновой протеазой, действующей на фактор XII и некоторые белки плазмы крови, например, плазминоген. Образуется во многих тканях. |
Большинство факторов свертывания постоянно циркулируют в крови в неактивной форме. Активацию этих факторов инициирует повреждение сосудистой стенки. При повреждении сосуда «включается» каскадный механизм последовательной активации коагуляционных белков с образованием трёх связанных с фосфолипидами клеточной мембраны ферментных комплексов. Каждый комплекс состоит из протеолитического фермента, белка-активатора и ионов Са2+: «VIIa-TФ-Ca2+» (внешняя теназа), «IXa-VIIIa-Ca2+» (внутренняя теназа), «Xa-Va-Ca2+» (протромбиназа) [1,2,3].
Современная каскадно-матричная (клеточная) теория предполагает, что в организме "внешний" и "внутренний" пути не изолированы друг от друга, а представляют собой единую систему, имеющую множество прямых и обратных положительных связей и перекрестных влияний отдельных факторов друг на друга [1,2,3].
С учетом данных о локализации и контроле коагуляционных реакций на различных клеточных поверхностях, процесс свертывания крови в настоящее время представляют в виде четырех перекрывающих друг друга стадий [1,2,3,4,5].
1 стадия – инициация. На поверхностях клеток, экспрессирующих ТФ (табл. 1) формируется комплекс «ТФ-VIIa-Ca2+», приводящий к образованию незначительного стартового количества тромбина.
2 стадия – амплификация. Эта стадия реализуется на поверхностях клеток (таких как активированные тромбоциты), содержащих прокоагулянтные фосфолипиды (см. табл. 1). Под влиянием стартового тромбина активируются тромбоциты, факторы V, VIII, XI, образуется внутренняя теназа «IXa-VIIIa-Ca2+», протромбиназа и тромбин.
3 стадия – пропагация. В эту стадию образуется значительное количество тромбина, способного сформировать сгусток фибрина.
4 стадия – терминация. В эту стадию происходит локализация фибринового сгустка в зоне повреждения. Подробно эта стадия будет рассмотрена в следующей части обзора.
КОАГУЛЯЦИОННЫЙ КАСКАД
1 стадия – инициация процесса свертывания крови
В крови все факторы свертывания, за исключением VII, находятся в неактивном состоянии. Около 1–2 % фактора VII циркулируют в активном состоянии (VIIa), но со слабой ферментативной активностью: конформация не позволяет ему взаимодействовать с плазменными факторами, и он не реагирует с другими факторами системы свертывания крови. При повреждении сосуда и разрушении клеток нарушается поперечная асимметрия плазматических мембран (см. табл. 1) тромбоцитов и эндотелиоцитов, на их поверхности формируются отрицательно заряженные (тромбогенные) участки и экспонируется апопротеин III ТФ (см. табл. 1). ТФ и внутренняя поверхность клеточной мембраны становятся доступными для плазменных факторов коагуляционного гемостаза. На поверхности ТФ-несущих клеток в месте повреждения сосудистой стенки формируются комплексы «TФ-VII-Ca2+» и «TФ-VIIa-Ca2+» [3].
ТФ является аллостерическим катализатором фактора VII и при соединении с ним активирует его ферментативные свойства. Образовавшийся комплекс «ТФ-VIIa-Ca2+» в свою очередь активирует фактор VII, связанный с ТФ. Это приводит к быстрому накоплению на месте травмы сосуда высокой концентрации комплекса «ТФ-VIIa-Ca2+», играющего главную пусковую роль в каскаде реакций, приводящих к формированию фибринового тромба (рис. 1).
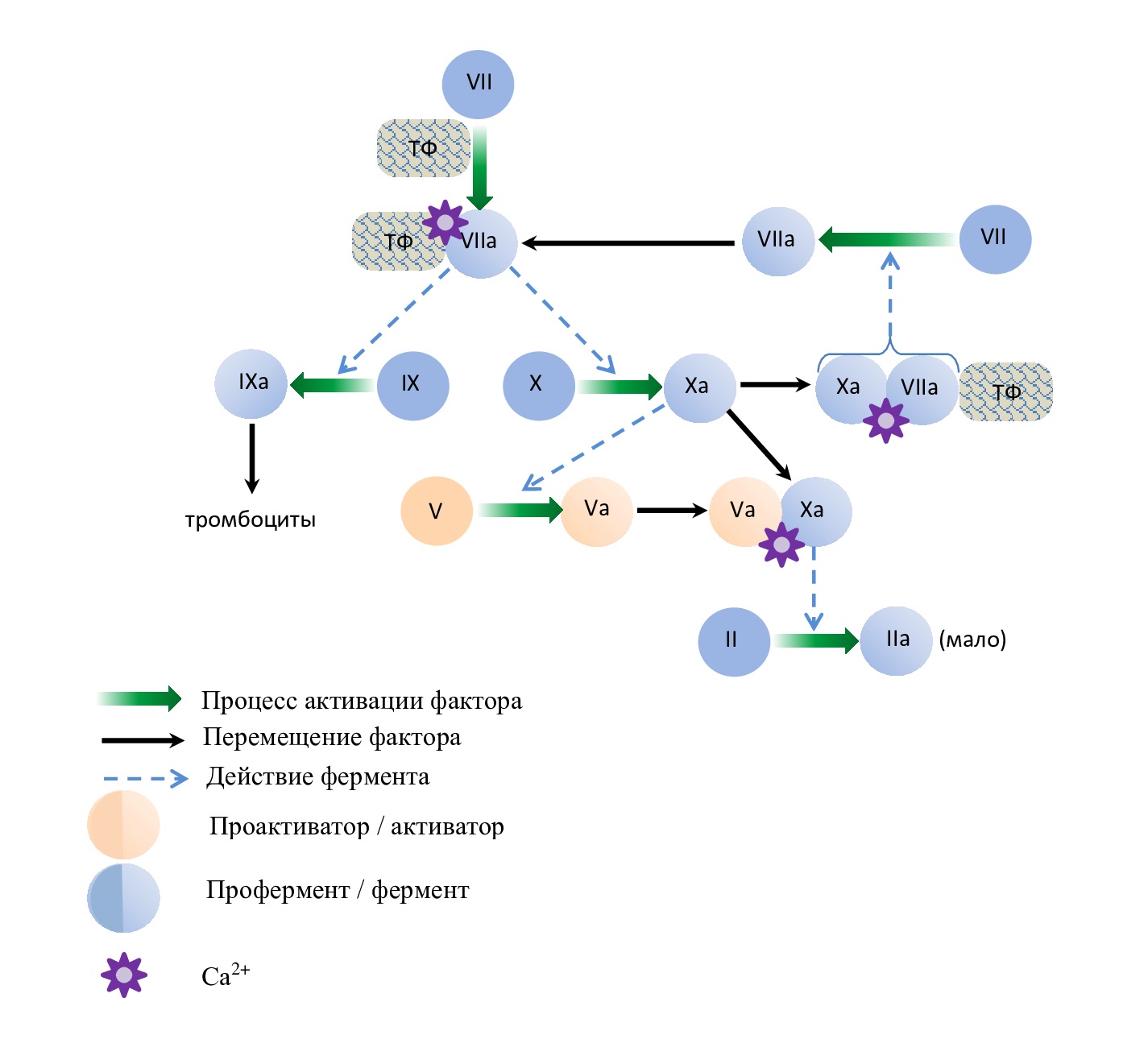
Рис. 1. Схема развития стадии инициации
Fig. 1. Scheme of development of the initiation stage
Также комплекс «ТФ-VIIa-Ca2+» протеолитически расщепляет небольшое количество факторов Х и IX . Затем фактор IXa мигрирует с места образования к тромбоцитам, находящимся в зоне повреждения сосуда, и связывается с их мембраной. Фактор Xa остается на поверхности клеток, несущих ТФ и участвует в образовании двух ферментных комплексов «Xa-Va-Ca2+», «ТФ-VIIа-Ха -Ca2+» (см. рис. 1.).
- Некоторое количество фактора Xa активирует кофактор V и образует с ним комплекс. Образовавшийся протромбиназный комплекс «Xa-Va» расщепляет протромбин, что приводит к образованию первых порций тромбина, необходимого для активации других компонентов системы гемостаза (см. рис. 1). Для превращения фибриногена в фибрин этого количества тромбина пока еще недостаточно, но он необходим для активации реакций, проходящих в стадию амплификации.
- Другая часть фактора Xa соединяется с комплексом «VIIа-ТФ-Ca2+» и формируется тройной комплекс «VIIа-ТФ-Xa-Ca2+», который по механизму положительной обратной связи (ретроградно) стимулирует образование новых порций фактора VIIa. Эта реакция увеличивает скорость активации следующих порций фактора X в 2×107 раз.
Фактор Xa может диссоциировать от клеток, экспрессирующих ТФ, на мембраны отдаленных неповрежденных клеток. Однако на эндотелии постоянно присутствуют ингибиторы активных факторов коагуляции, в том числе ингибитор пути тканевого фактора (активирует ингибитор фибринолиза), которые ограничивают эффективность диффундировавшего фактора Xa и других факторов свертывания. IXa не является мишенью для ингибитора пути тканевого фактора TFPI (tissue factor pathway inhibitor) и, следовательно, может легче диффундировать к другим поверхностям клеток [1,2,3,4].
2 стадия – амплификация (усиление процесса свертывания крови)
Процессы в эту стадию протекают на поверхности активированных тромбоцитов, имеющих специальные рецепторы для присоединения факторов свертывания.
Тромбоциты активируются и адгезируют к поверхности поврежденного сосуда под влиянием тромбина (наиболее сильного стимулятора тромбоцитов) и под влиянием обнажившегося при повреждении сосуда коллагена в субэндотелии. Активация тромбоцитов приводит к перестройке структуры их мембраны с экспозицией фосфатидилсерина, несущего отрицательный заряд, и секреции медиаторов. В плазму крови выделяются серотонин, АДФ, фактор Виллебранда, фибриноген и другие факторы, способствующие процессу свертывания.
Образовавшийся в первую стадию тромбин активирует расположенные на мембране тромбоцитов кофакторы V и VIII и фермент XI. Активированные факторы VIIIa и IXa при участии фосфолипидов и кальция образуют комплекс «IXa-VIIIa-Ca2+» – внутрення теназа и активируют фактор X (см. рис. 2). Под влиянием внутренней теназы скорость накопления фактора Xa увеличивается в 50–100 раз [1,2,3,4].
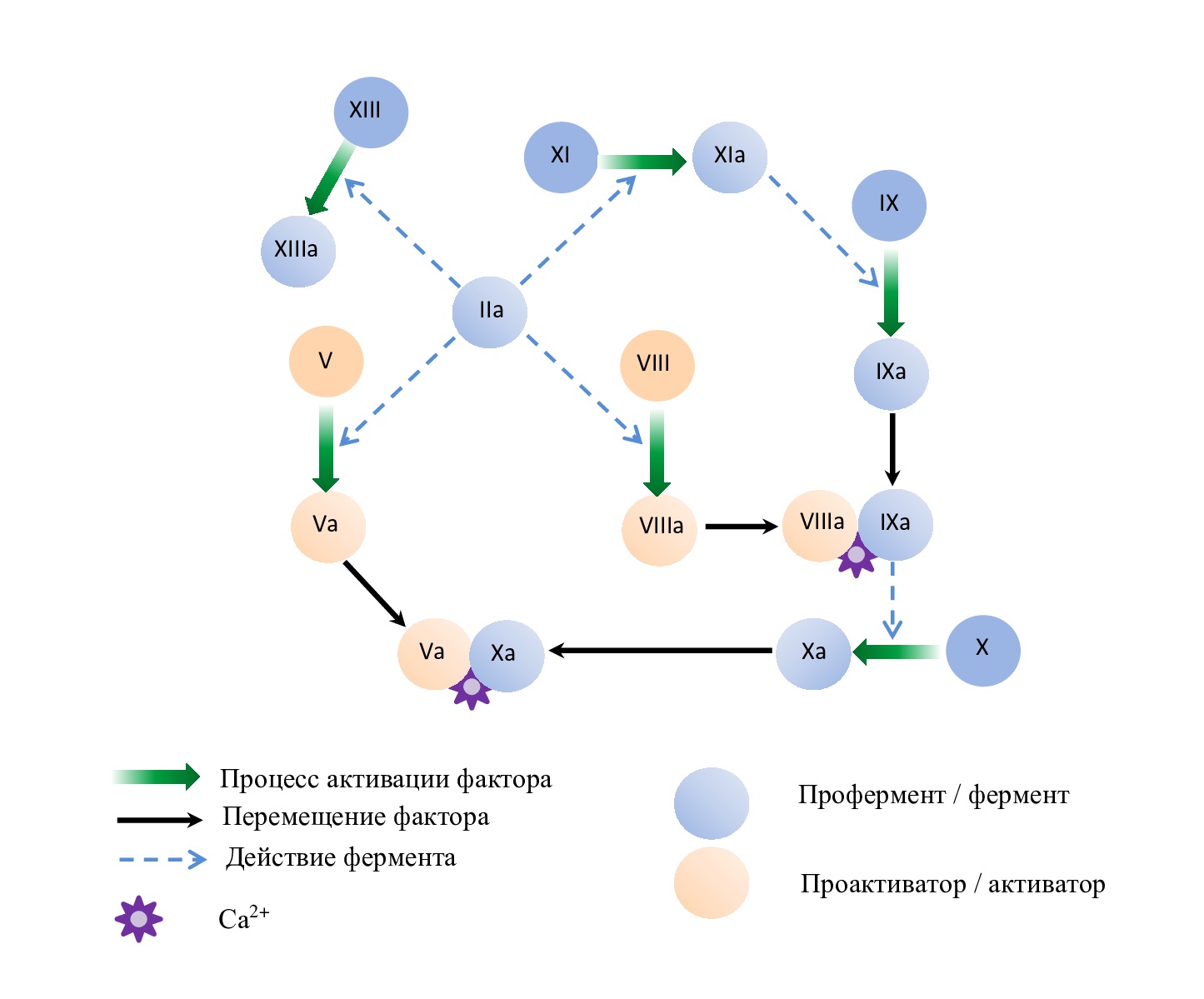
Рис. 2. Схема развития стадии амплификации
Fig. 2. Scheme of development of the amplification stage
Таким образом, события второй стадии обеспечивают образование протромбиназного комплекса «Xa-Va-Ca2+».
3 стадия – пропагация (распространения процесса свертывания крови)
В эту стадию возрастает скорость активирования факторов свертывания и протромбиназный комплекс производит достаточное количество тромбина для образования фибрина и формирования гемостатического тромба.
Тромбин преобразует фибриноген в фибрин-мономер и активирует фактор XIII (рис. 3). Фактор XIIIa катализирует образование ковалентных поперечных связей между соседними цепями фибрина и тем самым повышает механическую стабильность фибрина. В результате образуется эластичный полимеризованный фибриновый сгусток.
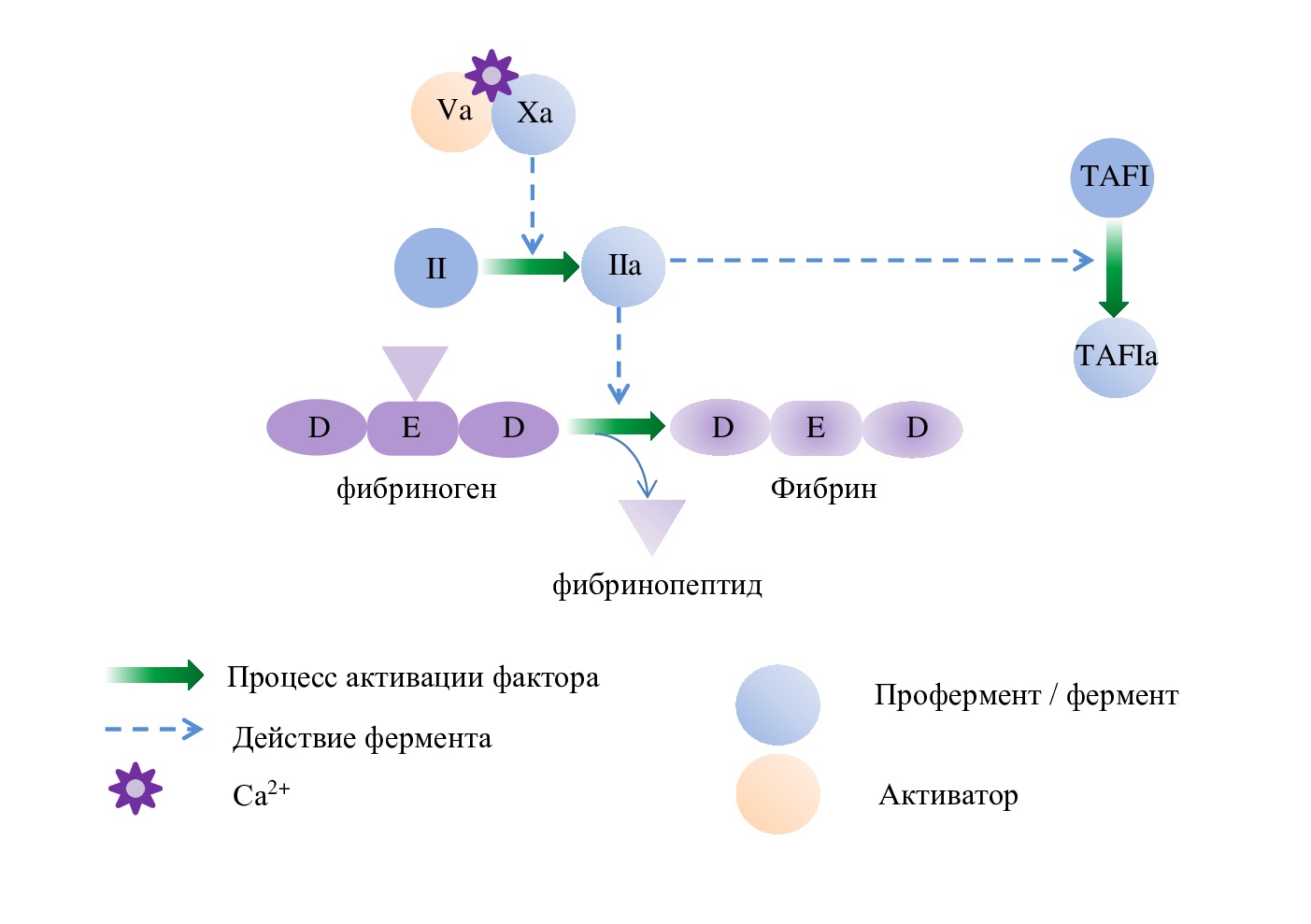
Рис. 3. Схема развития стадии пропагации,
где TAFI – ингибитор фибринолиза
Fig. 3. Scheme of development of the propagation stage,
where TAFI is a fibrinolysis inhibitor
Также при достаточном количестве тромбин активирует ингибитор фибринолиза TAFI, что дает время сформироваться плотному гемостатическому тромбу.
Механизм образования фибринового тромба
В процессе образования фибринового тромба растворимый фибриноген превращается в нерастворимый фибрин. Тромбин отщепляет фибринопептиды в молекуле фибриногена с образованием растворимых фибрин-мономеров. После этого начинается соединение фибрин-мономеров нековалентными связями с образованием олигомеров и, в конечном итоге, еще непрочной (растворимой) фибриновой сети (фибрин-полимер) [1,2,3,4,7].
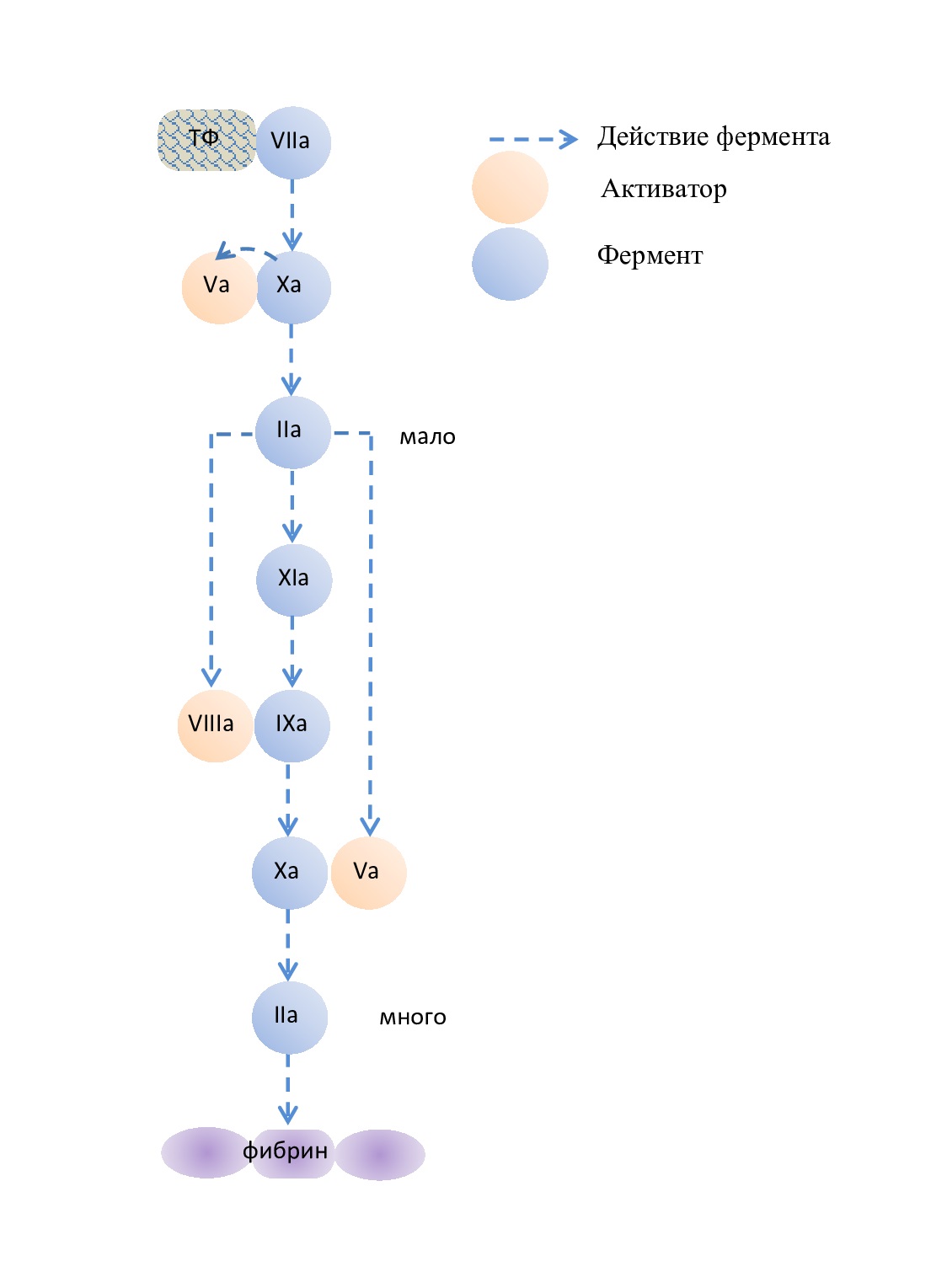
Рис. 4. Схема образования нерастворимой фибриновой сети,
где пунктирные линии – нековалентные связи, сплошные линии – ковалентные связи
Fig. 4. Scheme of formation of insoluble fibrin network,
where dotted lines are non-covalent bonds, and solid lines are covalent bonds
Далее фактор XIIIa в присутствии ионов Са2+ образует амидные связи между остатками лизина одной молекулы фибрин-полимера и остатками глутамина другой молекулы, чем связывает нити фибрин-полимера друг с другом (рис. 4). Ковалентно сшитые между собой нити фибрина образуют прочную трехмерную сеть, в которую включены тромбоциты, эритроциты и лейкоциты.
Также фактор XIIIa прикрепляет фибрин к фибронектину (см. табл. 1), прочно связанному с другими молекулами внеклеточного матрикса. В результате тромб прочно прикрепляется к стенке сосуда в области повреждения.
Фибрин через рецепторы GPIIb/IIIa соединяется с активированными тромбоцитами. Из них освобождается тромбостенин и осаждается на нитях фибрина. В результате сокращения тромбостенина происходит ретракция сгустка: сгусток крови уплотняется, из него выдавливается часть сыворотки. Формирование окончательного тромба наступает на 10–15 минуте после полимеризации фибрина.
Краткая схема коагуляционного гемостаза
Для лучшего понимания взаимодействия друг с другом активных факторов свертывания, мы приводим упрощенную схему коагуляционного гемостаза без путей взаимной активации, без указания предшественников ферментов (рис. 5). Все реакции гемостаза развертываются или на субэндотелии или (главным образом) на поверхности активированных тромбоцитов, несущих отрицательно заряженные фосфолипиды [2].
Действие фермента |
Белок-активатор |
фермент |
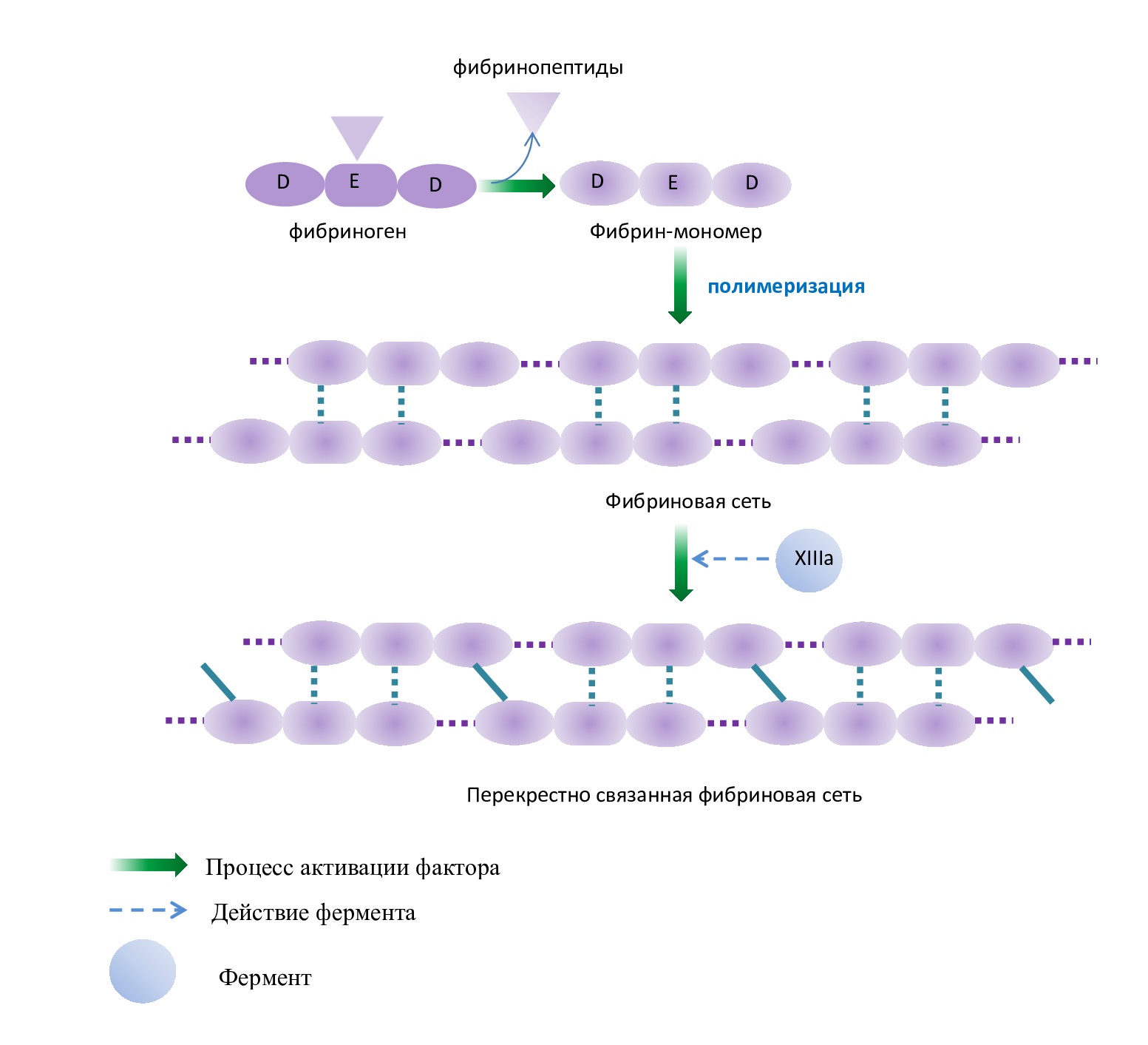
Рис. 5. Краткая схема коагуляционного гемостаза согласно клеточной биологической модели коагуляции
Fig. 5. Brief diagram of coagulation hemostasis according to the cellular biological model of coagulation
Современный взгляд на функции фактора XII
Фактор XII – это сериновая протеаза, которая вырабатывается преимущественно в печени и циркулирует в плазме в виде одноцепочечного зимогена.
Одной из наиболее изученных функций фактора XII является его участие во внутреннем пути свертывания крови. Однако люди с дефицитом этого фактора редко страдают от нарушений свертываемости крови. Исследования последних лет показали, что его биологическая роль гораздо шире.
Активация фактора XII осуществляется при контакте с отрицательно заряженными поверхностями, формирующимися при повреждении сосуда и обнажении отрицательно заряженного коллагена базальной мембраны. Это свойство фактора XII используется в лабораторной практике при исследовании гемостаза в in vitro на стекляной поверхности.
Также в последние годы обнаружены и другие многочисленные активаторы фактора XII:
- искусственные полимерные поверхности (катетер, искусственные клапаны сердца),
- некоторые биологически объекты, такие как неправильно свернутые белковые агрегаты, РНК, ДНК, нейтрофильные внеклеточные ловушки,
- неорганические полифосфаты, обнаруженные в том числе в плотных гранулах тромбоцитов, у некоторых бактерий, таких как Escherichia coli, Vibrio cholerae, Corynebacterium diphtheriae, Haemophilus influenzae. Показано, что полифосфат-зависимая активация фактора XII, по-видимому, не приводит к более быстрому образованию фибринового сгустка, а скорее к повышению его стабильности. Этот факт позволяет понять, почему высокие уровни фактора XII связаны с тромбозом, в то время как его дефицит может сделать сгусток нестабильным и привести к эмболизации.
При значительной травме на отрицательно заряженной поверхности субэндотелия сорбируются фактор XII, высокомолекулярный кининоген (ВМК), прекаликреин (ПК) и фактор XI. Соединение прекалликреина и фактора XI с поврежденной поверхностью осуществляется через ВМК. Фактор XII соединяется с тканями самостоятельно без участия ВМК. На отрицательно заряженной поверхности фактор XII за счет конформационных изменений медленно трансформируется с формированием активного центра и постепенно приобретает каталитическую активность. Фактор XIIа переводит небольшое количество прекалликреина в калликреин, а калликреин мембранного комплекса «калликреин-ВМК» активирует ограниченным протеолизом фактор XIIа (реципрокная, или взаимная активация). Процесс активации фактора XII очень медленный, происходит в течение 90–120 минут при контакте с отрицательно заряженной поверхностью и называется твердофазной активацией. Процесс активации фактора XII значительно ускоряется в присутствии ВМК, прекалликреина и называется активацией в жидкой фазе.
Образовавшийся калликреин и фактор XIIa расщепляют ВМК с образованием брадикинина, который, расширяя сосуды и увеличивая их проницаемость, является участником воспалительного процесса. Фактор XIIa также активирует систему комплемента по классическому пути (через активацию фрагментов С1r и С1s).
Одновременно с гемостазом XIIa инициирует фибринолиз, активируя урокиназный активатор плазминогена (uPA). Также показано, что расщеплять плазминоген могут сами факторы свертывания (XIIa и XIa) и калликреин, но менее эффективно, чем тканевой активатор плазминогена (tPA) и uPA. Также в фибринолизе принимает участие брадикинин, стимулируя высвобождение tPA из эндотелиальных клеток (рис. 6).
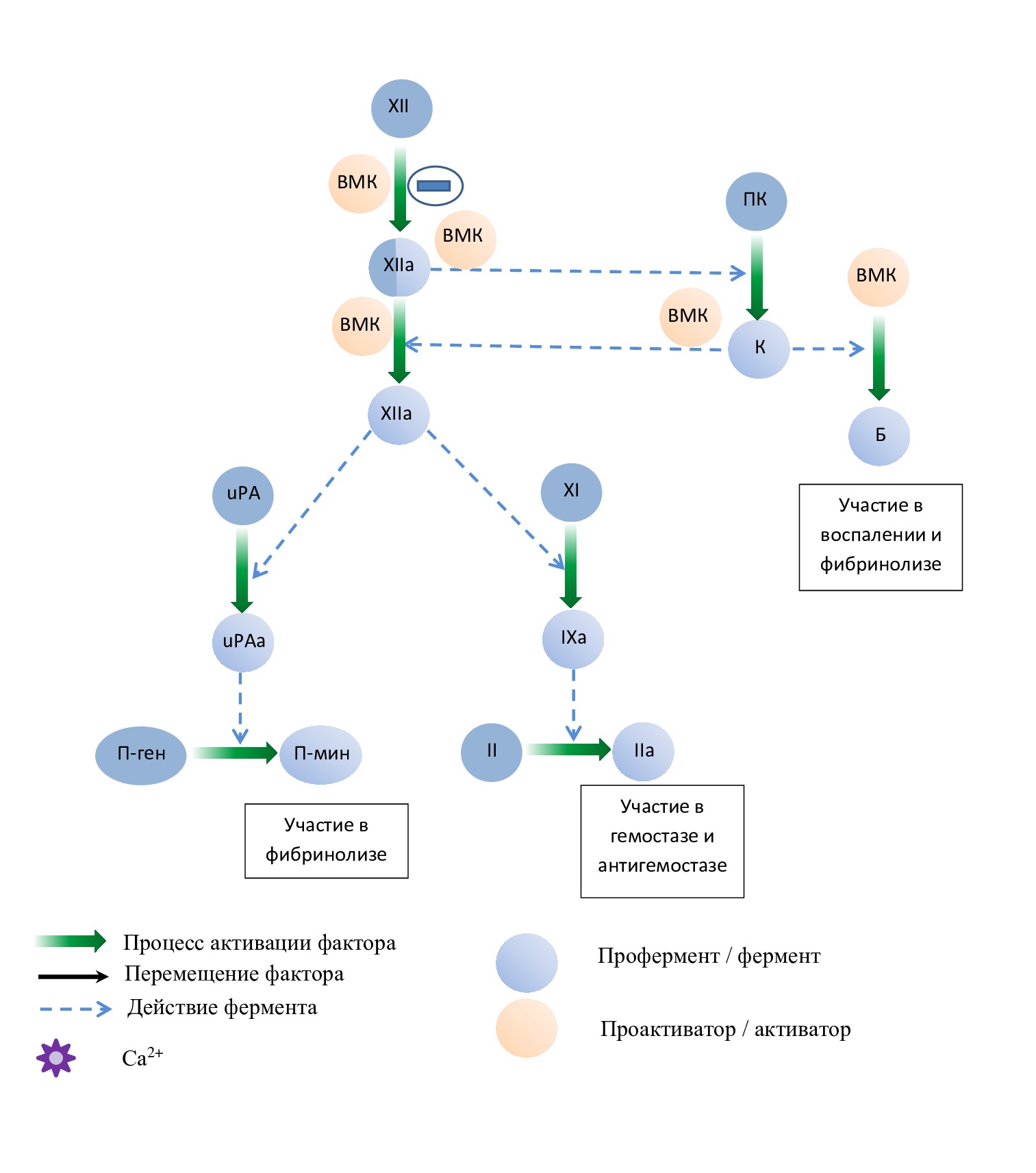
Рис. 6. Схема основных функций фактора XII,
где П-ген – плазминоген, П-мин – плазмин, Б– брадикинин, ПК– прекалликреин,
К – калликреин, ВМК – высокомолекулярный кининоген, uPA – урокиназный активатор плазминогена
Fig. 6. Schematic diagram of the main functions of factor XII,
where P-gen is plasminogen, P-min is plasmin, B is bradykinin, PK is prekallikrein, K is kallikrein, HMK is high-molecular-weight kininogen, uPA is urokinase plasminogen activator
Также, предполагают, что фактор XII оказывает влияние на метаболизм сосудов: он может связываться с рецептором uPA и далее через β1-интегрины и рецептор эпидермального фактора роста EGFR (epidermal growth factor receptor) стимулировать рост, пролиферацию и ангиогенез после повреждения [2,8,9,10,11].
Таким образом, биологическая роль фактора XII многообразна. Кроме того, что он является участником двух противоположных процессов, обеспечивающих гемостатический баланс – внутреннего пути свертывания крови и фибринолиза, фактор XII запускает контактную систему активации, калликреин-кининовую систему, активирует систему комплемента. Доказана его разнообразная роль в клеточном взаимодействии и клеточной регуляции, а именно – в процессах воспаления, пролиферации, ангиогенеза, клеточной миграции. Можно сказать, что фактор XII является связующим звеном коагуляции крови, воспалительных и аллергических реакций. В связи с этим целесообразно учитывать роль фактора XII при различных патологических состояниях.
ПАТОЛОГИЯ ГЕМОСТАЗА
Патология гемостаза может проявляться геморрагическими и тромбофилитическими синдромами. Стойкое преобладание гемостаза над антигемостазом приводит к тромбофилитическому синдрому, то есть частому и обильному формированию тромбов. Стойкая недостаточность гемостаза, по отношению к антигемостазу, проявляется в геморрагическом синдроме – наклонности к кровотечениям [12,13].
Геморрагические синдромы
Кровотечения могут быть обусловлены недостаточностью как сосудисто-тромбоцитарного, так и плазменного звена гемостаза. Нарушения, связанные с патологией плазменных факторов, принято называть коагулопатиями, которые бывают наследственными и приобретенными.
Наследственные (первичные) коагулопатии
Первичные коагулопатии обусловлены наследственным дефицитом факторов свертывания крови или их недостаточной активностью [13].
Среди наследственных геморрагических коагулопатий наиболее распространены гемофилии А и В [2,14].
На гемофилию А приходится приблизительно 85 % всех форм гемофилий, на гемофилию В – около 10 %. В основе обоих видов гемофилии лежит мутация генов фактора VIII (гемофилия А) или фактора IX (гемофилия В, болезнь Кристмаса) в Х-хромосоме. Болезнь при обеих формах наследуется по рецессивному, сцепленному с полом типу; носителями болезни являются женщины, а больными – лица мужского пола. Для гемофилий А и В характерна кровоточивость гематомного типа – болезненные кровоизлияния в крупные суставы (гемартрозы), мышцы, забрюшинную клетчатку, гематурия, тяжелые отсроченные посттравматические и послеоперационные кровотечения, в том числе при малых травмах и вмешательствах (при порезах, удалении зубов и т. п.).
К группе наследственных коагулопатий относят также аутосомно-доминантно наследуемую болезнь Виллебранда, при которой тромбоцитопатия сочетается с дефицитом фактора VIII. В основе патогенеза лежит частичный или полный дефицит фактора Виллебранда или нарушение его структуры, в результате чего он не может связаться с рецепторм тромбоцитов и фактором VIII. Это приводит к нарушению адгезии тромбоцитов и разрушению фактора VIII.
Кроме того, при болезни Виллебранда снижается содержание серотонина и развиваются патологическая дилатация сосудов и повышение их проницаемости.
Поскольку страдает как сосудисто-тромбоцитарное, так и плазменное звено гемостаза, кровотечения являются очень длительными. Также для данной патологии характерны эпизодические спонтанные кровотечения (носовые, десневые, из внутренних органов) [2,14].
Значительно реже встречаются коагулопатии вследствие дефицита иных факторов свертывания [15,16,17].
Наследственные дефициты факторов II, VII и X представляют собой редкие первичные коагулопатии.
К редким нарушениям свертывания крови (РНСК) относят наследственные дефициты или аномалии фибриногена, протромбина (фактора II), факторов свертывания крови V, VII, X, XI, XII, XIII. Все эти патологии в подавляющем большинстве случаев приводят к недостаточному формированию фибринового сгустка. Как правило, эти заболевания наследуются рецессивно.
Дефицит фактора XI приводит к развитию гемофилии С (около 5 % всех гемофилий). При гемофилии С геморрагический синдром является менее выраженным, спонтанные геморpагии в большинстве случаев отмечаются крайне редко, нет корреляции между уровнем фактора XI и тяжестью клинических проявлений.
Распространенность наследственного дефицита фактора свертывания крови II (протромбина) в большинстве стран составляет 1:2000000 населения. Описано около 20 случаев подобного нарушения.
Распространенность гипопроконвертинемии – 1:300000–500000 населения.
Средняя распространенность спорадических форм наследственного дефицита фактора Х составляет 1:1000000 населения.
Типичными для РНСК являются кровотечения/кровоизлияния, возникающие спонтанно или вследствие травмы. Геморрагический синдром представлен кровотечениями из слизистых (носовые, десневые, луночковые), экхимозами, гематомами мягких тканей различной локализации, кровотечениями во время и после хирургических вмешательств, меноррагиями, гематуриями, реже – кровоизлияниями в суставы [15,16,17].
Вторичные (приобретенные) коагулопатии
Приобретенные коагулопатии – это нарушения свёртываемости крови, возникающие вследствие различных заболеваний, патологических состояний и процессов в организме, а не обусловленные генетическими факторами [13,18].
Изолированный приобретенный дефицит отдельных факторов свертывания встречается крайне редко, за исключением специфической ингибиции факторов свертывания аутоантителами.
Основными причинами приобретенных коагулопатий являются следующие патологические состояния.
- Дефицит витамина К. Витамин К – обязательный кофактор микросомального печеночного фермента γ-карбоксилазы. Подвергаемые γ-карбоксилированию белки – это факторы свертывания II, VII, IX, X, белки-антикоагулянты C и S. Таким образом, коагулопатия при дефиците витамина К является комплексной и охватывает нарушение образования протромбиназы и тромбина и характеризуются разнообразием клинических проявлений от геморрагического синдрома до тромбоза.
Важнейшей нозологической формой гиповитаминоза К является геморрагическая болезнь новорожденных. У новорожденных наблюдается низкое содержание витамин К-зависимых факторов коагуляции: запас витамина К в печени к моменту рождения невелик, а симбионтная флора в кишечнике устанавливается только по мере начала кормления, поэтому она не поставляет витамин К в организм в первую неделю постнатальной адаптации. Ни женское, ни коровье молоко не являются богатыми источниками витамина К.
Гиповитаминоз К возможен в любом возрасте и основными его причинми являются:
- недостаточное поступление витамина K с пищей,
- нарушения всасывания (обтурационная желтуха, энтерит) и синтеза (кишечный дисбактериоз) витамина K в кишечнике,
- прием антагонистов витамина K (непрямого антикоагулянта варфарина и др.).
- Хронические заболевания печени (токсические и вирусные гепатиты, цирроз печени). Для гепатогенной коагулопатии характерны комплексные нарушения, которые развиваются вследствие:
- уменьшения синтеза факторов свертывания,
- уменьшения клиренса противосвертывающих факторов и синтеза α2-антиплазмина, что приводит к чрезмерной активации фибринолиза,
- нарушения сиалирования фибриногена и формирования дисфибриногенемии.
- Уменьшение циркуляции факторов свертывания при:
– миелоидной болезни, поскольку факторы свертывания соединяются с аномальными белками (парапротеинами) и не могут выполнять свою функцию;
– образовании и накоплении в организме аутоантител к факторам II, V, VIII, IX, X, XIII (при аутоиммунных заболеваниях, иммунизации экзогенными факторами свертывания в процессе заместительной терапии гемофилий, на фоне лечения антибиотиками и др.).
- Коагулопатия потребления при ДВС-синдроме. После гиперактивации системы гемостаза в крови истощаются факторы свертывания и вследствие этого формируется гипокоагуляция.
Тромбофилитические синдромы
Тромбофилитические синдромы характеризуются повышенным тромбообразованием, которое является звеном патогенеза многих заболеваний (инфаркты, инсульты, тромбоэмболия легочной артерии, тромбофлебит, флеботромбоз и т. п.).
Тромбофилитический синдром может быть, как наследственным, так и приобретенным [13].
Наследственные нарушения
- Мутация фактора V («лейденская мутация») – встречается у 5 % населения. Эта мутация формирует нечувствительность фактора V к инактивации антикоагулянтом протеином С. В результате снижается способность эндотелиоцитов разрушать протромбиназу и ограничивать фибринообразование. Это особенно проявляется в венах нижних конечностей, в которых снижена выработка простациклина и кровоток земедлен, что способствует развитию флеботромбоза [19].
- Наследственная гипергомоцистеинемия. Гомоцистеин снижает тромборезистентность сосудов и антикоагулянтные свойства эндотелия, активирует высвобождение ТФ, агрегацию тромбоцитов. Повышение гомоцистеина до 15–17 мкмоль/л (при верхней границе референсного интервала 12–15 мкмоль/л) связано, как правило, с алиментарными причинами и легко купируется добавлением в пищу фолатов и витамина В12. Плохо поддается коррекции и является более значимой высокая гипергомоцистеинемия – более 30–50 мкмоль/л.
Избыток гомоцистеина подавляет выработку эндотелиоцитами вазодилататоров – оксида азота и простациклина, при этом увеличивается концентрация тромбоксана А2, что приводит к повышеной адгезии и агрегации тромбоцитов. Кроме этого, в процессе окисления сульфгидрильных групп гомоцистеина образуются активные формы кислорода (супероксид-анион, гидроксильный радикал), активирующие процесс перекисного окисления липидов, повреждение мембран. В итоге на поверхности мембраны, контактирующей с кровью, появляется тканевый фактор [20,21,22].
- Аномалии отдельных фактров свертывания. Достаточно частыми тромбофилиями этой группы являются аномалии протромбина и фибриногена, гиперпродукция и повышение активности факторов VII (при гестозе, преэклампсии) и Намного реже тромбозы бывают связаны с дефицитом или аномалиями фактора XII (фактор Хагемана), при которых, как и при дисфибриногенемиях, наблюдается сочетание гипокоагуляции с нарушениями фибринолиза, формирующими тромбофилическое состояние [13].
Приобретенные тромбофилии
- Атеросклероз – одна из наиболее частых причин трмбофилитического синдрома: атеросклеротические бляшки имеют тромбогенную поверхность и являются источником липидных прокоагулянтов [13,23].
- Сахарный диабет. При данной патологии нарушаются различные звенья гемостаза, обусловленные во многом гликозилированием белков мембран клеток крови, эндотелиоцитов и факторов свертывания. В результате повышается адгезивность тромбоцитов, свойства факторов свертывания, фибринолиза и антикоагулянтов [24].
- Послеоперационный венозный тромбоз. Возникает вследствие активации гемостаза как результат травматизации тканей после хирургической операции и последующей гиподинамии [13].
- Новообразования. Часто сопровождаются паранеопластическим тромбозом: опухолевые клетки выделяют тканевой тромбопластин и провоспалительные цитокины. К этой группе тромбофилий относится синдром Труссо – острый, спонтанный, нередко мигрирующий тромбофлебит крупных вен у больных со злокачественными опухолями внутренних органов (легких, желудка, печени, поджелудочной железы и др.). Рецидивирующие и мигрирующие венозные тромбозы могут являться первым симптомом злокачественной опухоли [13].
- Гиперэстрогения. Избыток эстрогенов (как экзогенный, так и эндогенный) способствует повышению синтеза прокоагулянтов и снижению синтеза некоторых антикоагулянтов (например, антитромбина III) [13].
- Нефротический синдром. Протеинурия способствует потере с мочой низкомолекулярных антикоагулянтов и увеличению содержания в крови высокомолекулярных прокоагулянтов (фибриногена, факторов V, VIII), что может привести к избыточной активации коагуляции [13,25].
- Приобретенная гипергомоцистеинемия. Гомоцистеин образуется в организме человека в результате деметилирования метионина. Для последующего ресинтеза метионина из гомоцистеина необходимы фолиевая кислота и витамин В12, Дефицит этих витаминов нарушает процесс ресинтеза и приводит к накоплению гомоцистеина. Механизм нарушения гемостаза при гипергомоцистеинемии рассмотрен ранее [20,21,22].
- Антифосфолипидный синдром. В его основе лежит образование аутоантител к белкам, которые связаны с фосфолипидами клеточных мембран (антифосфолипидные антитела) эндотелиоцитов и других клеток. После образования иммунный комплекс индуцирует экспрессию этими клетками адгезионных молекул и тканевого фактора, а также подавляет активность ингибитора пути тканевого фактора (TFPI) и антикоагулянта протеина С. Характеризуется рецидивирующими артериальными и венозными тромбозами [26].
ТЕСТЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ОЦЕНКИ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
Исследования системы гемостаза можно разделить на скриниговые, дающие обзорную информацию, и углубленные, позволяющие оценить состояние гемостаза детально [27].
К скрининговым тестам коагуляционного гемостаза традиционно относятся определение времени свертывания крови, протромбинового времени, активированного частичного тромбопластинового времени, тромбинового времени и концентрации фибриногена (рис. 7).
Рис. 7. Схема скринговой диагностики состояния коагуляционного гемостаза
Fig. 7. Scheme of screening diagnostics of the state of coagulation hemostasis
В случае обнаружения патологических изменений в скрининговых показателях показано проведение уточняющих тестов, позволяющих провести дифференциальную диагностику причин выявленных нарушений.
Время свертывания крови
Время свертывания крови (ВСК) – время образования сгустка свежевзятой нестабилизированной венозной крови в стеклянной пробирке.
Время свертывания крови является ориентировочным показателем состояния коагуляционного каскада, в результате которого растворимый фибриноген переходит в нерастворимый фибрин. Данный показатель характеризует процесс свертывания в целом и не дает возможности выявить механизмы его нарушения. Нормальные показатели ВСК при комнатной температуре – 6–11 минут. Изменения ВСК приведены в таблице 2 [27,28,29,30,31].
Таблица 2. Основные причины изменения времени свертывания крови
Table 2. Main reasons for changes in blood clotting time
Укорочение | Увеличение |
- попадание в кровь тромбопластина (при механических повреждениях тканей, ожогах, обширных операциях, переливании несовместимой крови, сепсисе, васкулите и др.).
| - врожденный или приобретенный дефицит факторов свертывания, - повышение в крови концентрации различных антикоагулянтов. |
Укорочение времени свертывания свидетельствует о необходимости профилактики гиперкоагуляции. Увеличение времени свертывания крови указывает на склонность к кровоточивости.
Протромбиновый тест
Протромбиновый тест (ПТ) имитирует in vitro процесс активации коагуляционного гемостаза тканевым фактором. Определяют время образования фибринового сгустка в бедной тромбоцитами цитратной плазме при добавлении тканевого тромбопластина в присутствии ионов Са2+. Источником тромбопластина могут быть эритроциты, ткани мозга или другие ткани.
В настоящее время существуют следующие способы выражения результатов ПТ.
- Время свертывания в секундах (протромбиновое время – ПВ, N=10–20 с).
- Протромбиновый индекс (ПТИ), который определяется как:
- ПВконтрольной нормальной плазмы/ПВпациента ×100 %.
- Протромбиновое отношение – ПО (N=0,85–1,2), рассчитывается как
- ПВпациента/ПВконтрольной нормальной плазмы
- Протромбин по Квику (Quick) предусматривает определение концентрации факторов протромбинового времени по калибровочному графику (N=60–130%, зависит от препарата тромбопластина).
- Международное нормализованное отношение (МНО или International Normalised Index — INR). Представляет собой ПО, возведенное в степень Международного индекса чувствительности (МИЧ): МНО=ПОМИЧ. Референтные значения для МНО указывать некорректно, т. к. этот показатель должен исследоваться у больных, принимающих антикоагулянты непрямого действия; терапевтический интервал МНО выбирают в зависимости от показаний к назначению препаратов.
Основные причины изменения протромбинового времени и протромбинового теста по Квику приведены в таблице 3 [27,28,29,30,31].
Таблица 3. Основные причины изменения протромбинового времени, протромбинового теста по Квику
Table 3. The main reasons for changes in prothrombin time, prothrombin test according to Quick
Уменьшение ПВ, повышение ПТ по Квику | Увеличение ПВ, уменьшение ПТ по Квику |
- массивное поступление тканевого тромбопластина в кровоток (при травме, некрозе); - начальные стадии тромбоза глубоких вен нижних конечностей; - полицитемия; - беременность, - состояние после родов.
| - терапия непрямыми антикоагулянтами (антагонистами витамина К); - дефицит витамина К; - нарушение синтетической функции печени; - присутствие ингибиторов свертывания (гепарина, продуктов деградации фибрина); - ДВС-синдром в фазе гипокоагуляции. |
Увеличение протромбинового времени говорит о наклонности к гипокоагуляции. Укорочение протромбинового времени говорит о наклонности к гиперкоагуляции.
Тромбиновое время
Тромбиновое время (ТВ) – время, необходимое для образования сгустка фибрина в цитратной плазме при добавлении к ней тромбина. Оно зависит в основном от концентрации и свойств фибриногена и активности ингибиторов тромбина. Нормальные показатели ТВ=14–17 секунд.
Показания к исследованию: контроль за гепаринотерапией, контроль за тромболитической терапией, диагностика гиперфибринолитических состояний, диагностика афибриногенемии и дисфибриногенемии. Основные причины изменения ТВ приведены в таблице 4 [27,28,29,30,31].
Таблица 4. Основные причины изменения тромбиного времени
Table 4. Main reasons for changes in thrombin time
Укорочение | Удлинение |
- гиперфибриногенемия (фибриноген 6 г и выше); начальная, гиперкоагуляционная фаза ДВС-синдрома. | - присутствие в крови антикоагулянтов – гепарина или прямых ингибиторов тромбина (но не антагонистов витамина К); - гипофибриногенемия (фибриноген ниже 1 г/л) или дисфибриногенемия; - образование и накопление вторичных антикоагулянтов, таких как продукты деградации фибрина/фибриногена; - парапротеинемия (парапротеины ингибируют полимеризацию фибрина); - гипокоагуляционная фаза ДВС-синдрома - тромболитическая терапия стрептокиназой и др.); - дефекты в процессе получения крови для исследования (гемолиз, передозировка цитрата натрия, забор крови из гепаринизированного катетера). |
Активированное частичное (парциальное) тромбопластиновое время
Активированное частичное (парциальное) тромбопластиновое время (АЧТВ, АПТВ) или каолин-кефалиновое время – характеризует активацию in vitro коагуляционного гемостаза через активацию фактора XII.
Определяют время свертывания бедной тромбоцитами цитратной плазмы при добавлении ионов Са2+.
Заменителем тромбоцитарной фосфолипидной матрицы для сборки коагуляционных ферментных комплексов служит кефалин (фосфолипидный экстракт головного мозга, мембран эритроцитов или сои), заменителем активационной контактной поверхности – каолин или эллаговая кислота.
В практической медицине АЧТВ используется как скрининговый тест для оценки внутреннего каскада свертывания плазмы, определения присутствия волчаночного антикоагулянта и мониторинга антикоагулянтного действия гепарина. Нормальные значения АЧТВ – 20–45 секунд. Основные причины изменения результатов АЧТВ приведены в таблице 5 [27,28,29,30,31].
Таблица 5. Основные причины изменения АЧТВ
Table 5. Main reasons for changes in APTT
Укорочение АЧТВ | Удлинение АЧТВ |
- чаще всего укорочение АЧТВ объясняется нарушениями работы с кровью на преаналитическом этапе; - резистентность фактора V к антикоагулянту протеину С; - повышение уровня фактора VIII; - повышение уровня активированных факторов свертывания; - I фаза ДВС-синдрома.
| - врожденный или приобретенный дефицит факторов XII, XI, X, IX, VIII, V, II или наличие в крови их ингибиторов; - дефицит прекалликреина и/или высокомолекулярного кининогена; - наличие ингибиторов полимеризации фибрина; - тяжелая дисфибриногенемия или афибриногенемия; - дефицит фактора Виллебранда; - II и III фаза ДВС-синдрома; - наличие волчаночного антикоагулянта; - терапия гепарином и другими антикоагулянтами. |
Определение концентрации фибриногена
Фибриноген (фактор I) – это субстрат, из которого под действием тромбина образуется фибриновый сгусток, обеспечивающий полноценное свертывание крови. Нормальные значения его концентрации в крови – 1,8–4 г/л.
Хронометрический метод предполагает определение времени образования фибринового сгустка при добавлении избытка высокоактивного тромбина к разведенной в 10 раз плазме (для снижения влияния антитромбиновых компонентов). В этих условиях время реакции зависит в основном от концентрации фибриногена, которая определяется по калибровочному графику.
Высокий уровень фибриногена является доказанным фактором риска повышенного тромбообразования и сердечно-сосудистых заболеваний. Повышение концентрации фибриногена выше 4 г/л является прогностическим показателем развития инфаркта миокарда, инсульта, заболеваний периферических артерий.
Низкий уровень фибриногена (менее 1 г/л) может привести к развитию геморрагических осложнений, является фактором риска развития акушерских кровотечений. Основные причины изменения уровня фибриногена приведены в таблице 6 [27,28,29,30,31].
Таблица 6. Основные причины изменения уровня фибриногена
Table 6. Main reasons for changes in fibrinogen levels
Снижение фибриногена | Повышение фибриногена |
- Тяжелые заболевания печени с нарушением синтетической функции; - врожденные и приобретенные гипо- и дисфибриногенемии; - гиперпотребление фибриногена при ДВС-синдроме, травме, ожогах, шоке и др.
| - Любая острофазовая реакция (воспаление, инфекции, ожоги, травмы, острый инфаркт миокарда и др.); при этом гиперфибриногенемия коррелирует с тяжестью воспалительного процесса; - неопластические процессы; - легкие формы гепатита; - физиологическое увеличение концентрации фибриногена наблюдается у беременных женщин, особенно в III триместре. |
Делать заключение о нарушении свертывания крови только по одному скрининговому тесту нельзя. Следует комплексно оценивать все полученные показатели коагулограммы.
Заключение
Нарушение баланса между различными звеньями гемостаза сопровождает многие патологические процессы и заболевания. Знание и понимание роли основных участников процесса коагуляции необходимо для оказания адекватной помощи пациентам, страдающим геморрагическими или тромботическими синдромами. При этом, для полного понимания функционирования системы гемостаза важно учитывать не только процессы тромбообразования, но также механизмы расщепления сформировавшегося тромба и предотвращения чрезмерного тромбообразования. Процессы фибринолиза и системы антикоагулянтов будут рассмотрены в следующей части обзора.
Список литературы
1. Леонтьева Н.В. Характеристика факторов свертывания крови. Актуальные проблемы теоретической и клинической медицины. 2019; 3(25):9-13 [Leontyeva N.V. Characteristics of blood coagulation factors. Actual problems of theoretical and clinical medicine. 2019, 3(25):9-13 (In Russian)]. URL: https://kazrosmedjournal.krmu.edu.kz/jour/article/view/191 [дата доступа: 08.05.2025]
2. Кузник Б.И. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии. Чита:Экспресс-издательство; 2010:832 [Kuznik B.I. Cellular and molecular mechanisms of regulation of the hemostasis system in norm and pathology. Chita:Еxpress publishing house; 2010:832 (In Russian)]
3. Леонтьева Н.В. Каскадная модель свертывания крови. Актуальные проблемы теоретической и клинической медицины. 2019;3(25):14-18. [Leontyeva N.V. Cascade model of blood coagulation. Actual problems of theoretical and clinical medicine. 2019;3(25):14-18 (In Russian)]. URL: https://kazrosmedjournal.krmu.edu.kz/jour/article/view/192/190?locale=ru_RU [дата доступа: 08.05.2025]
4. Счастливцев И.В., Лобастов К.В., Цаплин С.Н. и др. Современный взгляд на систему гемостаза: клеточная теория. Медицинский совет. 2019; 16:72-77 [Schastlivtsev I.V., Lobastov K.V., Tsaplin S.N. et al. A modern view of the hemostasis system: cellular theory. Medical Council. 2019, 16:72-77 (In Russian)]. https://doi.org/10.21518/2079-701X-2019-16-72-77
5. Butenas S., Orfeo T., Mann K.G. Tissue factor in coagulation: Which? Where? When? Arterioscler Thromb Vasc Biol. 2009;29(12):1989-1996. https://doi.org/10.1161/ATVBAHA.108.177402
6. Long A.T., Kenne E., Jung R., Fuchs T.A., Renné T. Contact system revisited: an interface between inflammation, coagulation, and innate immunity/ Jоurnal thrombosis and haemostasis. 2015;14(3):427-437. https://doi.org/10.1111/jth.13235
7. Versteeg H.H., Heemskerk Johan W.M., Levi M., Reitsma P.H. New Fundamentals in Hemostasis. Рhysiological Reviews. 2013;93(1):327–358. https://doi.org/10.1152/physrev.00016.2011
8. Шашок Л.В., Кабаева Е.Н., Цвирко Д.Г. Дефицит FXII фактора свертывания (фактора Хагемана) – редкая коагулопатия или частая лабораторная находка? Лабораторная диагностика Восточная Европа. 2023;12(4):551-557 [Shashok L.V., Kabaeva E.N., Tsvirko D.G. Deficiency of FXII Coagulation Factor (Hageman Factor) is a Rare Coagulopathy or a Common Laboratory Finding? Laboratory Diagnostics Eastern Europe. 2023;12(4):551-557. (In Russian)] https://doi.org/10.34883/PI.2023.12.4.006
9. Maat S. Maas C. Factor XII: form determines function. Journal of Thrombosis and Haemostasis. 2016;14(18):1498-1506. https://doi.org/10.1111/jth.13383
10. Яровая Г.А., Блохина Т.Б., Нешкова Е.А. Контактная активация протеолитических систем плазмы крови. Новые концепции о механизмах активации и биорегулирующих функциях. Лабораторная медицина. 2008;9:19-26 [Yarovaya G.A., Blokhina T.B., Neshkova E.A. Contact activation of proteolytic systems of blood plasma. New concepts on mechanisms of activation and bioregulatory functions. Laboratory Medicine. 2008,9:19-26 (In Russian)]. https://doi.org/10.17116/oftalma2016132488-93
11. Яковлева Е.В., Зозуля Н.И. Физиологическая и патологическая роль фактора свертывания крови XII. Гематология и трансфузиология. 2022,67(4):570-578 [Yakovleva E.V., Zozulya N.I. Physiological and pathological role of factor XII. Russian journal of hematology and transfusiology. 2022;67(4):570-578 (In Russian)]. https://doi.org/10.35754/0234-5730-2022-67-4-570-578
12. Gale A.J. Continuing education course №2: current understanding of hemostasis. Toxicol Pathol. 2011;39(1):273-80. https://doi: 10.1177/0192623310389474
13. Литвицкий П.Ф. Патология системы гемостаза. Вопросы современной педиатрии. 2014;13(2):65-76 [Litvitsky P.F. Pathology of the hemostasis system. Issues of modern pediatrics. 2014;13(2):65-76 (In Russian)]. https://doi.org/10.15690/vsp.v13i2.974
14. Гемофилия. Клинические рекомендации РФ, 2023. Утверждены Минздравом РФ. [Hemophilia. Clinical guidelines of the Russian Federation, 2023. Approved by the Ministry of Health of the Russian Federation (In Russian)]. URL: https://cr.minzdrav.gov.ru/recomend/127 [дата доступа: 08.05.2025]
15. Редкие коагулопатии: наследственный дефицит факторов свертывания крови II, VII, X. Клинические рекомендации. Утверждены Минздравом России, 2023 [Rare coagulopathies: hereditary deficiency of coagulation factors II, VII, X. Clinical guidelines. Approved by the Ministry of Health of the Russian Federation, 2023 (In Russian)]. URL: https://cr.minzdrav.gov.ru/recomend/149 [дата доступа: 08.05.2025].
16. Флоринский Д.Б., Жарков П.А. Редкие коагулопатии. Российский журнал детской гематологии и онкологии. 2020;7(3):54-63 [Florinsky D.B., Zharkov P.A. Rare coagulopathies. Russian Journal of Pediatric Hematology and Oncology. 2020;7(3):54-63 (In Russian)]. https://doi.org/10.21682/2311-1267-2020-7-3-54-63
17. Lippi G., Franchini M., Montagnana M., Favaloro E. J.. Inherited disorders of blood coagulation. Annals of Medicine. 2011;44(5):405–418. https://doi.org/10.3109/07853890.2011.576698
18. Palta S., Saroa R., Palta A. Overview of the coagulation system. Indian J Anaesth. 2014;58(5):515-523. https://doi.org/10.4103/0019-5049.144643
19. Albagoush S.A., Koya S., Chakraborty R.K., Schmidt A.E. Factor V Leiden Mutation. 2023 Apr 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025. URL: https://www.ncbi.nlm.nih.gov/books/NBK534802/ [дата доступа: 08.05.2025]
20. Костюченко Г.И. Гипергомоцистеинемия: клиническое значение, возрастные особенности, диагностика и коррекция. Клиническая геронтология. 2007;4:32-40 [Kostyuchenko G.I. Hyperhomocysteinemia: clinical significance, age-related features, diagnostics and correction. Clinical Gerontology. 2007;4:32-40 (In Russian)]. URL: https://cyberleninka.ru/article/n/gipergomotsisteinemiya-klinicheskoe-znachenie-vozrastnye-osobennosti-diagnostika-i-korrektsiya [дата доступа: 08.05.2025]
21. Dong-Feng Wu, Rui-Xing Yin, Jin-Long Deng, Homocysteine, hyperhomocysteinemia, and H-type hypertension, European Journal of Preventive Cardiology.2024 31(9):1092–1103. https://doi.org/10.1093/eurjpc/zwae022
22. Coppola A., Davi G., De Stefano V., [et al.] Homocysteine, coagulation, platelet function, and thrombosis. Semin Thromb Hemost. 2000;26(3):243-254. https://doi.org/ 10.1055/s-2000-8469
23. Воробьев А.И., Васильев С.А., Городецкий В.М. и др. Гиперкоагуляционный синдром: классификация, патогенез, диагностика, терапия. Гематология и трансфузиология. 2016;61(3):116-122 [Vorobiev A.I., Vasiliev S.A., Gorodetsky V.M. et al. Hypercoagulation syndrome: classification, pathogenesis, diagnostics, therapy. Hematology and transfusiology. 2016;61(3):116-122 (In Russian)]. https://doi.org/10.18821/0234-5730-2016-61-3-116-122
24. Бондаренко И.З. Ширшина И.А. Механизмы тромбообразования, ассоциированные с сахарным диабетом: что определяет прогноз интервенционного вмешательства. Сахарный диабет. 2013;16(3):58-63 [Bondarenko I.Z., Shirshina I.A. Mechanisms of thrombus formation associated with diabetes mellitus: what determines the prognosis of interventional intervention. Diabetes mellitus. 2013;16(3):58-63 (In Russian)]. https://doi.org/10.14341/2072-0351-95
25. Бернс А.С., Советников Е.Н., Чеботарева Н.В. и др. Оценка нарушений гемостаза с использованием теста тромбодинамики у больных хроническим гломерулонефритом с нефротическим синдромом. Терапевтический архив. 2022;94(6):738-742 [Burns A.S., Sovetnikov E.N., Chebotareva N.V., et al. Evaluation of hemostasis disorders using a thrombodynamics test in patients with chronic glomerulonephritis with nephrotic syndrome. Therapeutic archive. 2022;94(6):738–742(In Russian)]. https://doi.org/10.26442/00403660.2022.06.201558
26. Arreola-Diaz R., Majluf-Cruz A., Sanchez-Torres L., Hernandez-Juarez J. The Pathophysiology of The Antiphospholipid Syndrome: A Perspective From The Blood Coagulation System. Clinical and Applied Thrombosis/Hemostasis. 2022;28. https://doi.org/ 10.1177/10760296221088576
27. Кишкун А.А. Клиническая лабораторная диагностика. М.: ГЭОТАР-Медиа;2021:720 [Kishkun A.A. Clinical laboratory diagnostics. М.: GEOTAR-Media; 2021:720 (In Russian)] https://doi.org/10.33029/9704-6084-9-CLD1-2021-1-784
28. Вавилова Т.В., Варданян А.В., Самойленко В.В. и др. Интерпретация коагулограммы при нарушениях свертывания крови. М.:ГЭОТАР-Медиа; 2024:176 [Vavilova T.V., Vardanyan A.V., Samoylenko V.V. et al. Interpretation of coagulogram in blood clotting disorders. M.: GEOTAR-Media;2024:176 (In Russian)]. https://doi.org: 10.33029/9704-8111-0-ICD-2024-1-176.
29. Долгов В.В. Клиническая лабораторная диагностика. В 2 томах. Том 1. национальное руководство / Под ред. В. В. Долгова. Москва : ГЭОТАР-Медиа, 2013:928 [Dolgov V.V. Clinical laboratory diagnostics. In 2 volumes. Volume 1: national guidelines / Ed. by V.V. Dolgov. Moscow: GEOTAR-Media, 2013:928(In Russian)]. URL : https://www.rosmedlib.ru/book/ISBN9785970421291.html [дата доступа: 08.05.2025]
30. Система гемостаза. Теоретические основы и клиническая практика. Под ред. Рукавицына О.А., Игнатьева С.В. Москва : ГЭОТАР-Медиа;2024:944 [Hemostasis system. Theoretical foundations and clinical practice. Edited by Rukavitsyn O.A., Ignatiev S.V. Moscow: GEOTAR-Media; 2024:944 (In Russian)]. https://doi.org/10.33029/9704-8497-5-THS-2024-1-944
31. Ревматология : национальное руководство. Под ред. Е.Л. Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа; 2010:720. [Rheumatology: national guide. Ed. E.L. Nasonova, V.A. Nasonova. M.:GEOTAR-Media;2010:720 (In Russian)]. URL : https://www.rosmedlib.ru/book/ISBN9785970416501.html [дата доступа: 08.05.2025]
Об авторах
Людмила Олеговна ГуцолРоссия
к.б.н., доцент, доцент кафедры патологической физиологии и клинической лабораторной диагностики
Ирина Эдуардовна Егорова
Россия
к.м.н., доцент, доцент кафедры химии и биохимии
Игорь Жанович Семинский
Россия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики
Евгения Владимировна Гузовская
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Светлана Николаевна Серебренникова
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Людмила Аркадьевна Дмитриева
Россия
к.м.н., зав. лабораторией клинической диагностики
Рецензия
Для цитирования:
Гуцол Л.О., Егорова И.Э., Семинский И.Ж., Гузовская Е.В., Серебренникова С.Н., Дмитриева Л.А. КОАГУЛЯЦИОННЫЙ ГЕМОСТАЗ: СОВРЕМЕННЫЙ ВЗГЛЯД, ПАТОЛОГИЯ, ДИАГНОСТИКА. Байкальский медицинский журнал. 2025;4(2):32-52. https://doi.org/10.57256/2949-0715-2025-4-2-32-52
For citation:
Gutsol L.O., Egorova I.E., Seminsky I.Zh., Guzovskaiia E.V., Serebrennikova S.N., Dmitrieva L. COAGULATION HEMOSTASIS: MODERN VIEW, PATHOLOGY, DIAGNOSTICS. Baikal Medical Journal. 2025;4(2):32-52. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-2-32-52
















