Перейти к:
КЛЕТОЧНЫЕ ТЕХНОЛОГИИ (ЛЕКЦИЯ)
https://doi.org/10.57256/2949-0715-2025-4-2-92-107
Аннотация
Актуальность. Клеточные технологии являются перспективным направлением современной медицины, которое позволяет разрабатывать методики, способные преодолеть ранее неразрешимые проблемы оказания медицинской помощи.
Цель исследования: в доступной форме изложить основные понятия и направления развития современных клеточных технологий.
Методы. Основу лекции составляет анализ отечественных и зарубежных источников за последние 15 лет.
Результаты. Показано, что клеточные технологии являются современной инновационной базой для проведения репарационной терапии, имеют большое значение для развития трансплантологии, фармакологии и других медицинских направлений. Развитие клеточных технологий тесно связано с понятием о стволовых клетках. В лекции рассмотрены основные принципы их культивирования и применения.
Заключение. Клеточные технологии – перспективный метод современной регенеративной медицины. Развитие клеточных технологий и управление развитием стволовых клеток открывают целый ряд новых направлений оказания медицинской помощи, таких как биопринтинг, биобанкинг, заместительная и регенеративная терапия.
Для цитирования:
Ткачук Е.А., Семинский И.Ж., Карагяур М.Н. КЛЕТОЧНЫЕ ТЕХНОЛОГИИ (ЛЕКЦИЯ). Байкальский медицинский журнал. 2025;4(2):92-107. https://doi.org/10.57256/2949-0715-2025-4-2-92-107
For citation:
Tkachuk E.A., Seminsky I.Zh., Karagyaur M.N. CELLULAR TECHNOLOGIES (LECTURE). Baikal Medical Journal. 2025;4(2):92-107. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-2-92-107
Актуальность
Развитие молекулярно-генетических технологий позволяет современной медицине разрабатывать новые методы и технологии лечения самых сложных нарушений здоровья, в том числе и ранее неизлечимых. К таким методам относятся клеточные технологии, которые начали свое бурное развитие в начале прошлого столетия и на сегодняшний момент выделены в самостоятельное научное направление, имеющее огромные перспективы. В настоящее время разрабатываются такие направления клеточных технологий как регенеративная медицина, выращивание и биопринтинг искусственных органов, биобанкирование [1].
Введение
Клеточная терапия – перспективный метод лечения, который подразумевает коррекцию заболеваний на клеточном уровне. Современные клеточные технологии - это совокупность методов, направленных на выделение отдельных типов клеток, их культивирование с последующим использованием самих клеток или продуктов их жизнедеятельности в восстановлении поврежденных органов и тканей человека [2].
История вопроса
Понимание роли и функций стволовых клеток позволило развиваться клеточной терапии как отдельному направлению в лечении больных. Началось все с Роберта Гука, который в 1665 г. открыл ячеистое клеточное строение растений. В 1683 г. А. Левенгук впервые описал морфологию одноклеточных организмов, что привело к созданию в 1839 г. М. Шлейденом и Т. Шванном клеточной теории [3].
Первая попытка лечения с помощью клеток относится к 1891 г., когда физиолог и невропатолог Шарль Броун-Секар и физиолог Жак д’Арсонваль попытались излечить больного лейкемией путем приема вытяжки костного мозга «per os». Но естественно потерпели неудачу, хотя были на верном пути [4].
Важный вклад в развитие клеточных технологий внес русский гистолог профессор Военно-медицинской академии Александр Александрович Максимов (рис. 1). До сих пор А.А. Максимов считается одним из основоположников учения о гемопоэтических стволовых клетках. Изучая морфологию воспаления в течение тридцать лет, он описал гемоцитопоэз в костном мозге и его стадии, сформулировал представления о «полибласте», что было отражено в его докладе о стволовых клетках в 1908 г.. А.А. Максимов изучал соединительную и кроветворную ткань, лимфоузлы, применяя методы окрашивания клеточных культур. Ему удалось доказать, что костномозговая соединительная ткань на протяжении всей жизни организма сохраняет недифференцированные, камбиальные клетки, способные дифференцироваться в лимфоциты и специализироваться как клетки соединительной ткани и крови [5].
 Рис.1. А.А. Максимов - основоположник учения о гемопоэтических стволовых клетках
Рис.1. А.А. Максимов - основоположник учения о гемопоэтических стволовых клетках
Fig. 1. A.A. Maksimov - the founder of the theory of hematopoietic stem cells
В 1914 г. А.А. Максимов издал учебник «Основы гистологии», в который были включены иллюстрации, сделанные автором (рис. 2) [6].
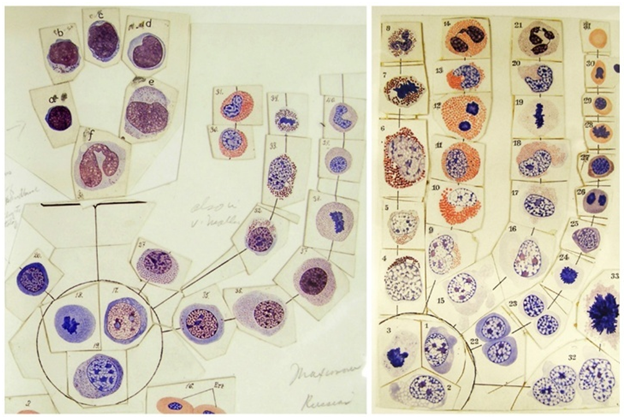 Рис. 2. Варианты схемы кроветворения, стволовые клетки – в круге. Рисунок А.А. Максимова. Из библиотеки Чикагского университета [6]
Рис. 2. Варианты схемы кроветворения, стволовые клетки – в круге. Рисунок А.А. Максимова. Из библиотеки Чикагского университета [6]
Fig. 2. Variants of the hematopoiesis scheme, stem cells are in a circle. Drawing by A.A. Maksimov. From the library of the University of Chicago [6]
Полученные данные вдохновили других исследователей, и уже в 1925 г. был создан первый в мире Центр биологических ресурсов коллекции клеток ATCC (американская коллекция типовых культур). Он включил наиболее известные сегодня референс-штаммы и клеточные линии, что придало импульс дальнейшему развитию клеточных технологий [7].
В 1940 г. Моррис и Самвак совершили первую успешную пересадку костного мозга больному с апластической анемией от монозиготного близнеца [8].
В 1948 г. была показана возможность производства вакцин в культуре клеток, а в 1951 г. получена линия клеток названная HeLa по имени пациентки Генриетты Лакс (рис 3), от которой были получены эти клетки. Генриетта Лакс - афроамериканка, умершая от аденокарциномы шейки матки в 1951 г. стала невольным источником биоматериала, на основании которого создана линия широко использующихся в научных целях «бессмертных» клеток HeLa. Клетки аденокарциномы Генриетты Лакс, ставшие основой клеточной линии HeLa, являются носителями высокоонкогенного вируса папилломы человека HPV18, который подавляет активность ключевых негативных регуляторов клеточного цикла, - p53 и pRB. Помимо, этого в клетках HeLa повышена активность фермента теломеразы, восстанавливающая концевые участки хромосом - теломеры [9]. Все это в совокупности обеспечивает способность клеток HeLa практически неограниченно делиться, что отличает их от нормальных (нетрансформированных) соматических клеток, для которых существует предел Хейфлика - лимит раундов делений клеток человека in vitro, открытый Леонардом Хейфликом в 1961 г. [9].
 Рис. 3. Генриетта Лакс стала невольным источником культуры клеток HeLa [9]
Рис. 3. Генриетта Лакс стала невольным источником культуры клеток HeLa [9]
Fig. 3. Henrietta Lacks became the unwitting source of HeLa cell culture [9]
В 1968 г. А. Я. Фриденштейном были описаны мезенхимальные стволовые клетки, а в 1977 г. А. Я. Фриденштейн и И. Л. Чертков обобщили известные на тот момент данные в монографии «Клеточные основы кроветворения». В 1975 г. С.Мильштейн, Ж. Келер и Н. Ерне разработали технологию гибридoм и производства моноклональных антител, за что в 1984 г. получили Нобелевскую премию по физиологии и медицине [10].
Последующие открытия внесли весомый вклад в развитие современных клеточных технологий. Так в 1981 г. были получены эмбриональные стволовые клетки мыши. В 1996 г. Яном Вилмутом (Ian Wilmut) клонирована овечка Долли. В 1998 г. Джеймсом Томсоном были получены эмбриональные стволовые клетки человека. Одновременно с ним Джон Гирхарт из Университета Джона Гопкинса в США опубликовал статью на эту же тему в Анналах национальной академии США. Последующие исследования позволили Шиньи Яманака в 2006 г. установить транскрипционные факторы, ответственные за формирование плюрипотентности, и получить с их помощью индуцированные плюрипотентные стволовые клетки, за что он в 2012 г. удостоен Нобелевской премии вместе с Дж. Гордоном, который за несколько десятков лет до этого клонировал лягушку. Бурный рост клеточных технологий способствовал принятию в 2017 г. в России закона, регламентирующего правила получения, обращения и применения клеток для терапии: «О биомедицинских клеточных продуктах» [11].
Понятие о стволовых клетках
Основу клеточных технологий составляют стволовые клетки. Стволовая клетка (СК) – это клетка-предшественница всех клеток и тканей нашего организма, характеризующаяся следующими свойствами: она неспециализированная, недифференцированная, самообновляющаяся и способна делится ассиметрично. СК способны к дальнейшей широкой специализации и сохраняют эту способность в течение жизни (рис. 4) [12].
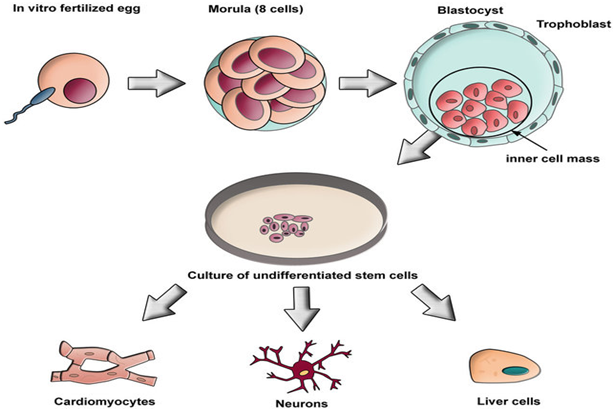 Рис. 4. Генерация эмбриональных стволовых клеток. Оплодотворенная яйцеклетка развивается до стадии бластоцисты [13]
Рис. 4. Генерация эмбриональных стволовых клеток. Оплодотворенная яйцеклетка развивается до стадии бластоцисты [13]
Fig. 4. Generation of embryonic stem cells. The fertilized egg develops to the blastocyst stage [13]
В 1961 году профессор Л. Хейфлик обнаружил, что клетки человека делятся ограниченное число раз и гибнут приблизительно после 50 делений. Порог в 50 делений назвали пределом Хейфлика [14]. В дальнейшем было доказано, что лимит Хейфлика связан с теломерами, которые «отмеряют», сколько раз может делиться клетка. За это открытие в 2009 г. Элизабет Блекберн, Кэрол Грейдер и Джек Шостак получили Нобелевскую премию. Понимание роли теломер имеет огромное значение для реализации клеточных технологий. Теломерами являются концы хромосом, которые предохраняют хромомсому от потери нуклеотидов (генетического материала). Теломеры состоят из одной и той же последовательности азотистых оснований (у человека – TTAGGG), которая повторяется около 3 тысяч раз. Длину теломеры поддерживает фермент теломераза (рис. 5). Обычная клетка после определенного количества делений в искусственной среде (пассажей), со временем теряет теломеры и в результате либо стареет и дегенерирует, либо трансформируется и превращается в постоянную клеточную линию [13].
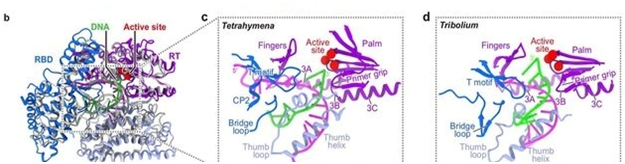 Рис. 5. Схематическое строение теломеразы на примере Tetrahymena (род свободноживущих пресноводных ресничных инфузорий) и Tribolium castaneum (жук семейства чернотелок) [15]
Рис. 5. Схематическое строение теломеразы на примере Tetrahymena (род свободноживущих пресноводных ресничных инфузорий) и Tribolium castaneum (жук семейства чернотелок) [15]
Fig. 5. Schematic structure of telomerase using the example of Tetrahymena (a genus of free-living freshwater ciliates) and Tribolium castaneum (a beetle of the darkling beetle family) [15]
Стволовые клетки обладают неограниченной способностью к делению, так как могут восстанавливать свои теломеры. Высокая экспрессия регуляторных генов, таких как НохВ4, Неs-1 или AMLI-ETO приводит к делению стволовых клеток in vitro и in vivo. Однако известны и другие гены, которые активно экспрессируются в стволовых клетках: такие как OCT3, SOX2, KLF4, c-MYC, NOTCH, NANOG, LIN28, ZEB1, SNAIL, VIM, TWIST. Они называются генами «стволовости». Изучение их активности имеет значение для диагностики опухолей [16].
Понятие о «нише»
Дифференцировка стволовых клеток зависит от многих факторов, которые участвуют в эпигенетической регуляции стволовых клеток и их трансформации в определенный тип клеток. Это, так называемое, понятие о "нише" или микроокружении стволовой клетки, необходимом для её жизнедеятельности и координации поведения на уровне организма. К функциям "ниши" относятся: обеспечение стабильного окружения стволовой клетки, контроль дифференцировки и самообновления СК, поддержка СК в состоянии покоя (в недифференцированном состоянии), защита СК с помощью молекул внеклеточного матрикса и адгезии (рис. 6) [17].
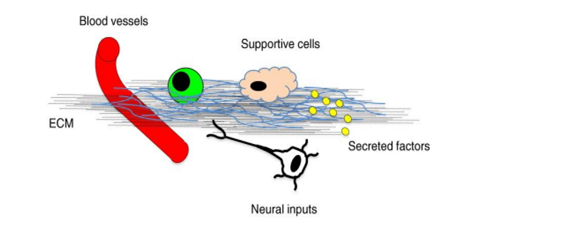 Рис. 6. Компоненты в «нише» стволовых клеток [17]
Рис. 6. Компоненты в «нише» стволовых клеток [17]
Fig. 6. Components in the stem cell “niche” [17]
«Нишу» составляет определенный тип стволовых клеток и окружающих их клеток, каждая «ниша» регулируется своими межклеточными сигналами, такими как CXCL12, SCF; Тро, SHH, Angl 1 [18].
Согласно Гаврилову О.К. и др. (1985) [19] дифференцируются не более 40 % СК, 60 % СК необходимы для самоподдержания пула. Однако до сих пор обсуждаются вопросы: как сочетается способность СК к самоподдержанию своей популяции и старение, как происходит коммитирование (определение дальнейшего пути развития клеток), дифференцировка и созревание, переход в дочерние клетки, Известно, что должна быть материальная граница для разделения в пространстве и времени этих событий. Р.Скофилд (Schofield R.,1978) [20] в своей гипотетической концепции о кроветворной «нише» предположил, что СК нужна базальная мембрана (для адгезии), молекулы внеклеточного матрикса и окружающие клетки (для продукции факторов роста и регуляторных молекул и обеспечения необходимых условий для поддержания фенотипа СК). Вне «ниши» СК гибнут [20].
Основные пути пролиферации и дифференцировки клеток контролируются сигнальными путями Notch, Wnt и Shh [21].
Классификация стволовых клеток по способности дифференцироваться
Стволовые клетки различаются по способности дифференцироваться. Имеются тотипотентные, плюрипотентные, мультипотентные и унипотентные СК (рис. 7) [22].
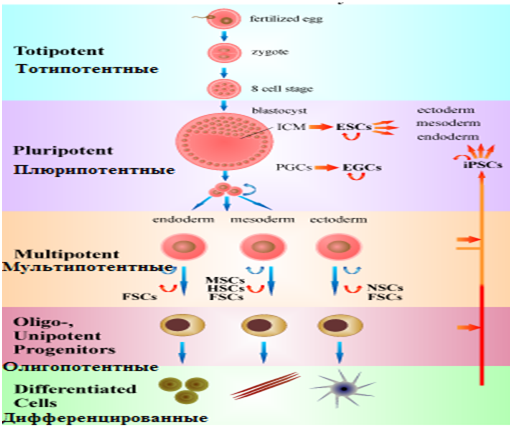 Рис. 7. Классификация стволовых клеток по способности дифференцироваться [22]
Рис. 7. Классификация стволовых клеток по способности дифференцироваться [22]
Fig. 7. Classification of stem cells by their ability to differentiate [22]
Тотипотентость – это способность клетки дифференцироваться в любую клетку организма, включая ткани желточного мешка и плаценты. Тотипотентностью обладает зигота до 5-6 клеточных циклов ее дробления. Тотипотнтность определяют гены: TPRX1, ZSCAN4, ZSCAN5B, DUXA/B и ZNF280A. При дальнейшем дроблении зиготы эти гены снижают свою экспрессию за счет эпигенетических механизмов и становятся плюрипотентными [23].
Плюрипотентность - это способность клетки дифференцироваться во все типы клеток, кроме клеток внезародышевых органов (плаценты и желточного мешка). Как известно это клетки 3-х зародышевых листков и тканей из них развивающихся.
Эктодерма дает начало эпидермису кожи, железам кожи, волосам, ногтям, нервной системе. Если происходят нарушения в этом зародышевом листке, то стигмы дизэмбриогенеза, которые мы можем увидеть при обследовании кожных покровов будут указывать на нарушение развития в эктодерме, и будут косвенно указывать на нарушение развития нервной системы [23].
Мезодерма дает начало мышечной и соединительной тканям, мочевыделительной и половой системам, хорде. Нарушения мезодермального зародышевого листка будут сопровождаться нарушениями в тканях и органах, преимущественно состоящих их этих тканей [24].
Энтодерма дает начало эпителию желудочно-кишечного тракта (ЖКТ) и пищеварительным железам, а также эпителию дыхательной системы. К плюрипотентным стволовым клеткам относятся эмбриональные стволовые клетки (ЭСК), стволовые клетки эпибласта (EpiSCs), эмбриональные половые клетки (гоноциты), индуцированные плюрипотентные стволовые клетки (ИПСК) [24].
Мультипотентные стволовые клетки дают начало клеткам в пределах одного зародышевого листка, например, мезенхимальным и гемопоэтическим СК [23].
Также выделяют унипотентные СК - это незрелые клетки тканей, их еще называют региональные СК. Они дают начало той ткани, в которой располагаются. У них ограниченное количество делений и, как правило, это клетки-предшественники и бластные клетки [23, 24].
Классификация стволовых клеток по этапу развития
Гистогенетические процессы начинаются в эмбриональном периоде, основное развитие получают до рождения, но и после рождения продолжаются с меньшей скоростью (см. табл.1).
Таблица 1. Дифференциальные возможности стволовых клеток
Table 1. Differential capabilities of stem cells
Тип клеток | Эмбриональные СК (ЭСК) | Фетальные СК | СК пуповинной и плацентарной крови (СКП) | Взрослые СК |
Получение | Внутренняя клеточная масса бластоциста | Абортивный материал на 9–12 неделе беременности | Пуповинная кровь, плацента | Из тканей взрослого человека |
Самообновление | Высокое | Высокое | Высокое | Ограниченное |
Потентность | Тотипатентность | Смесь мультипотентных и унипотентных стволовых клеток | Плюрипотентность | Мультипотентность |
Дифференцировка | Дифференцируются на клетки трех зародышевых листков | Дифференцируются на клетки трех зародышевых листков | Дифференцируются на клетки трех зародышевых листков | Дифференцируются только в рамках одного зародышевого листка |
Спонтанная онкогенная трансформация | Присутствует | Присутствует | Низкая | Отсутствует |
В зависимости от этапов развития СК различаются по времени развития или по этапу онтогенеза. Так выделяют эмбриональные стволовые клетки (ЭСК), к которым относятся эмбриональные СК, фетальные СК (ФСК), СК пуповинной и плацентарной крови и Adult stem cells (постнатальные, соматические, региональные) стволовые клетки (РСК), к которым относятся стволовые клетки кожи, жировой ткани, мышечной ткани, нервной ткани, костного мозга и резидентные стволовые клетки сердца (рис.8) [24,25].
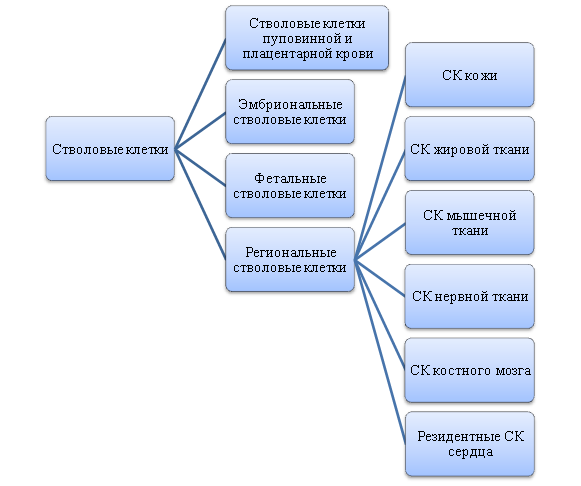
Рис. 8. Классификация стволовых клеток по времени развития
Fig. 8. Classification of stem cells by development time
Характеристики стволовых клеток
Дифференцировка ЭСК происходит с помощью факторов дифференцировки, они же являются маркерами ЭСК и определяют их плюрипотентность. При искусственном выращивании таких клеток, т.е. культивировании ЭСК, эффективность их дифференцировки в клетки тканей определяются множеством параметров, такими как плотностью посева, pH, температурой, составом культуральной среды и доступностью факторов роста. ЭСК могут образовывать тератомы, гомогенные колонии округлой формы, химеры. Выделяют ЭСК иммунохирургическим, механическим методами и с помощью лазерных технологий.
Региональные стволовые клетки (РСК) дают начало определенному типу ткани. Мезенхимальные мультипотентные стволовые клетки (МСК) дают начало соединительной ткани, сосудам, гладким мышцам. Нервные стволовые клетки (НСК) дают начало нейронам, олигодендритам, астроцитам, гемопоэтические СК - клеткам крови, эпителиальные - клеткам покровов, периваскулярные и эндотелиальные СК - сосудам [26].
Стволовые клетки пуповинной крови человека (UCB) дают начало всем вышеуказанным типам тканей.
Мезенхимальные мультипотентные стволовые (стромальные) клетки (МСК) представляют собой клетки соединительной ткани, присутствующие в костном мозге, жировой ткани, пуповинной крови, околоплодных водах и зубочелюстной системе. Они обычно располагаются в периваскулярной нише, что позволяет им быть более динамичными и легко мигрировать внутри системы кровообращения к поврежденным тканям для их поддержания и восстановления. Дифференцируются МСК в клетки соединительной ткани, костную, хрящевую и жировую ткани, и могут применяться для реконструкционной хирургии данных типов тканей. При определённых условиях можно направлять дифференцировку МСК по неродственным путям: в нейроны, кардиомиоциты и др. типы клеток [27].
Эндотелиальные стволовые клетки-предшественники (EPC) формируют новые кровеносные сосуды. Клоногенность, самообновление и потенциал дифференцировки определяется следующими генами: CD34, CD146, CD45, CD115, CD14, CD133, VEGFR1, VEGFR2 (или KDR) [27].
Гемопоэтические стволовые клетки (ГСК) находится в костном мозге, из них в результате дифференцировки и созревания образуются все виды клеток крови: эритроциты, мегакариоциты (продуцируют тромбоциты) и различные виды лейкоцитов.
Стволовые клетки пуповинной крови человека (UCB) при своевременном их криоконсервировании сразу после рождения могут в дальнейшем использованы для лечении рассеянного склероза, атаксии Фридрейха, миастении и миодистрофии, системной красной волчанки, ревматоидного артрита, онкологических заболеваний, ишемической болезни сердца. Уже сейчас с помощью пуповинных СК лечат лейкозы, талассемию, апластическую анемию Фанкони, неходжкинскую лимфому, лизосомные болезни накопления, остеопетроз и др [28].
Долгое время считалось, что нервные клетки не восстанавливаются, однако это не так. Стволовые клетки в мозге располагаются в субвентрикулярной зоне (СВЗ) и зубчатой извилине (рис. 9). В связи с тем, что обонятельные нервные клетки часто гибнут, организмом предусмотрено их обновление в обонятельной луковице [29]. Из субвентрикулярной зоны клетки мигрируют по так называемой ростральной миграционной системе. Сама субвентрикулярная зона содержит эпиндимальные клетки и астроциты. Они образуют каналы, которые называют глиальными трубками и по ним происходит миграция вновь образованных нейробластов к обонятельной луковице. Астроциты в ростральных трубках обеспечивают питание клеток. Сейчас уже известны молекулярные маркеры, позволяющие не только идентифицировать стволовые нервные клетки, но и определять фазы их развития. Так нестин является маркером для стволовой клетки, виментин - для клетки-предшественника, а полисиалилированная молекула адгезии нервных клеток и даблкортин являются маркерами нейробластов [30].
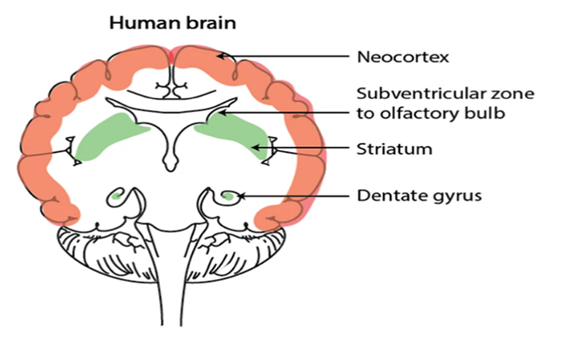 Рис. 9. Области нейрогенеза в мозге взрослого человека [29]
Рис. 9. Области нейрогенеза в мозге взрослого человека [29]
Fig. 9. Areas of neurogenesis in the adult human brain [29]
Мышечные стволовые клетки (MSC) еще называются Satelles (сателлитные мышечные клетки, миосателлитоциты) – это одноядерные взрослые стволовые клетки – спутники мышечной ткани. Миосателлиты расположены между базальной и клеточной мембраной скелетного мышечного волокна и используются организмом для постнатального мышечного роста. Эти клетки можно получить с помощью биопсии и выделить с помощью антител миосателлитов с одновременной экспрессией факторов транскрипции PAX7 и поверхностных белков CD56 и CD29. Выделенные из биоптата миосателлиты человека ученые трансплантировали мышам с поврежденными мышцами, у которых была резко уменьшена популяция собственных мышечных стволовых клеток. В течение пяти недель клетки человека успешно интегрировались в мышцы мышей и размножились, пополнив нишу стволовых клеток для восстановления поврежденной мышечной ткани [32].
Культивирование
Культуры можно различать по происхождению клеток в зависимости от типа исходной ткани: соединительная ткань (лимфоциты, фибробласты, хрящевые клетки), мышечная ткань (скелетная, гладкая, сердечная мышцы); эпителиальные ткани (печень, легкие, почки), нервная ткань, эндокринная ткань (надпочечники, гипофиз), опухолевые клетки. В зависимости от степени специализации ткани различают эмбриональную либо взрослую ткань. В зависимости от физиологического состояния различают нормальную либо опухолевую ткани, а от способа культивирования: однослойные и многослойные [35].
Примером постоянных или перевиваемых культур служат клеточные линии, способные неограниченно размножаться in vitro, также как клетки HeLa [9].
Свойствами постоянных культур являются их способность к неограниченному количеству генераций, анеуплоидность, потеря многих характеристик клеток-доноров, возможность выращивания в неограниченном количестве при многократном пассировании (возраст культуры считают по числу пассажей) [36].
По сути, эти клетки являются бессмертными из-за повышения активности теломеразы. Такие клетки используются в экспериментальных целях и в ряде биотехнологических производств, например, при создании вакцин и получении моноклональных антител [9].
Получение первичной культуры происходит в несколько этапов, которые включают: забор образца ткани (источником чаще являются эмбриональные ткани), механическая и ферментативная дезагрегация образца ткани, получение суспензии клеток, ресуспендирование клеток в питательной среде и перенос в культуральные сосуды, формирование однослойной или монослойной культуры [36].
Условия культивирования могут различаться. Существуют непроточные культуры, которые находятся в фиксированном объеме, среда которых периодически обновляется, а погибшие/не прикрепившиеся клетки удаляются, и проточные культуры, где клетки находятся в гомеостатических условиях с питательными веществами в определенных концентрациях, а метаболиты плавно отводятся.
Применение стволовых клеток
Использование мезенхимальных стволовых клеток для регенерации хряща запускает продукцию коллагена II типа, ускоряет восстановление переломов, облегчает боли и улучшает качество хрящевой ткани при остеоартрите [41].
МСК предполагается использовать в комбинированной терапии при заболевании легких, что улучшает показатели качества жизни пациентов и снижает степень тяжести бронхолегочной дисплазии при легочной гипертензии, эмфиземы легких, фиброзе, остром респираторном дистрессе-синдроме, остром повреждении легких, опухоле легкого, резистентных формах туберкулеза легких [42].
При заболеваниях печени использование МСК восстанавливает неоваскуляризацию и улучшает функции печени.
Терапию стволовыми клетками применяют при заболеваниях сетчатки глаза, успешно восстанавливая функцию сетчатки. ЭСК могут помочь скорректировать остроту зрения и повысить показатели качества жизни при дегенерации желтого пятна. СК способствуют образованию новых межклеточных связей, регенерации клеток и восстановлению различных зрительных функций. Активация природных механизмов иммунитета против бактериальных и вирусных агентов при использовании клеточных технологий позволяет стабилизировать внутриглазное давление, сохранить прозрачность хрусталика, расширить питающие глаз сосуды и нормализовать кровоснабжение, стимулировать синтез здоровых клеток и замедлить возрастные изменения [44].
СК используют и в стоматологии для выращивания зубов, пластики расщелины губы («заячья губа») и неба («волчья пасть») [46].
Биопринтинг
В 2000 году Томас Борланд сконструировал первый биопринтер и благодаря этому изобретению стал возможен биопринтинг. В настоящий момент жизнеспособность клеток при биопринтировании составляет 90%. В качестве расходного материала биопринтер использует небиологический бесклеточный материал, такой как порошки или гели) для создания 3D-каркаса органа, и биологические живые клетки в качестве материала для заполнения структуры. Трехмерная (3D-модель) органа формируется с помощью программного обеспечения автоматизированного проектирования (CAD), которое сегментирует и последовательно накладывает медицинские 2D- изображения (такие как КТ, МРТ и т. д.). 3D-модели сохраняются в виде цифровых файлов (STL, AMF). Обычно 3D-печать используется для имплантации бесклеточных структур в хирургии. В настоящее время обсуждается технология сборки живых клеток, биоматериалов и биохимических веществ в функциональные тканеподобные структуры. 3D-биопечать эволюционировала от обычного процесса 3D-печати каркасов с последующим засевом их клетками к одновременному процессу, который создает 3D-биопечатную матрицу и клетки одновременно. После имплантации этих клеточных биологических структур 3D-биопечать имеет потенциал для интеграции инженерной ткани в естественную ткань, что позволит восстановить естественную функцию ткани и органа [47].
Выращивание органов
Сегодня ученые предпринимают попытки выращивания внутренних органов, которые можно использовать в дальнейшем для трансплантации. Это решило бы множество проблем трансплантологии, таких как иммунологическая несовместимость, труднодоступность донорских органов и этические ограничения. В настоящий момент известно об удачном опыте выращивания костей учеными Колумбийского университета и израильской компании Bonus Biogroup. Клетки крови успешно вырастили исследователи из Университета Пьера и Марии Кюри в Париже, кожу вырастили в Институте регенеративной медицины при Университете Питсбурга, где было изобретено устройство для пересадки кожи, клетки костного мозга получили ученые из лаборатории химической инженерии Мичиганского Университета, мочевой пузырь вырастили из собственных клеток пациентов в американском университете Вэйк Форест (Wake Forest University) и в дальнейшем использовали для трансплантации, почки вырастили в компании Advanced Cell Technology в 2002 г. из одной клетки, взятой из уха коровы [48]. Основным недостатком разрабатываемых тканеинженерных конструкций является сложность обеспечения их адекватного кровоснабжения (формирования разветвленной сети капилляров), что затрудняет их приживаемость в организме реципиента.
Биобанкинг
Для использования СК и применения клеточных технологий необходимы банки стволовых клеток (биобанкинг). Биобанк – персональное/неперсональное хранилище образцов СК, где могут находиться клетки пуповинной крови, клетки костного мозга, гаметы и эмбрионы [48].
Биобанкирование позволяет сохранять образцы биологического материала в течение нескольких лет для последующего анализа и использования. Привлечение ресурсов биобанков расширяет возможности научных исследований, повышает доступ к высококачественным образцам и ассоциированными с ними данным. Биобанки классифицированы Европейским консорциумом по инфраструктуре биобанков и исследований биомолекулярных ресурсов (BBMRI-ERIC — Biobanks and Biomolecular Resources — European Research Infrastructure Consortium). Так выделены популяционные и болезнь-ориентированные (нозологические) биобанки [49]. Популяционные биобанки предполагают сбор материала в рамках многоцентровых когортных исследований с охватом большой популяции с относительно лояльными критериями включения и невключения. Нозологические биобанки создаются для детального изучения конкретных заболеваний, углубления знаний об их патогенезе, поиска новых прогностических маркеров и терапевтических мишеней.
Биобанкирование позволяет развиваться омиксным исследованиям, которые объединяют методологию геномики, протеомики, метаболомики и транскриптомики. Эти технологии позволяют получать обширные данные о генах, белках, метаболитах и РНК, что открывает новые возможности для медицины. В сочетании с искусственным интеллектом (ИИ), омиксные технологии могут значительно улучшить диагностику, лечение и прогнозирование заболеваний. В свою очередь омиксные технологии могут развиваться благодаря существованию биобанков [49].
Перепрограммирование иммунных клеток
Одним из инновационных методов клеточной терапии является CAR Т-клеточная терапия. Метод использует потенциал собственного иммунитета человека, в частности белок Т-клеток ST3GAL1, который может направить Т-клетки прямо к опухоли. У пациента берут его Т-клетки и в лабораторных условиях «перепрограммируют» их, чтобы они могли распознавать раковые клетки. Затем эти перепрограммированные клетки вводятся пациенту, в результате Т-клетки, нацеленные на специфические антигены, поступают непосредственно к опухоли.
В НМИЦ им. В. А. Алмазова лабораторное получение и тестирование противоопухолевых генетически модифицированных Т-клеток человека (CAR-T) проводят с 2014 года. Помимо CAR Т-клеточной терапии разработана CAR NK-клеточная терапия [50].
В условиях развития современной медицины стал возможен искусственный гаметогенез. Исследователи из Julang Liиз University of Guelph [Канада], сообщают, что вместе с коллегами они превратили стволовые клетки, выделенные из эмбриональной кожи свиньи, в клетки, сильно напоминающие овоциты. В дальнейшем из этих клеток можно получить эмбриональные тела [51].
Осложнения клеточной терапии
Данные многочисленных исследований, проведенных в разных странах, подтвердили, что стволовые клетки и рак взаимосвязаны, поэтому использование стволовых клеток может стать причиной появления новых злокачественных опухолей или увеличения уже существующих. Это связано с трудностью управления СК.
Мутации наблюдались в стволовых клетках, культивируемых в течение ряда поколений, и было замечено, что некоторые мутировавшие стволовые клетки ведут себя как раковые. Неконтролируемый рост приводит к образованию опухоли. Микробиологическая чистота и безопасность аллогенных стволовых клеток (контаминация вирусами, прионами, бактериями и пр) также остается актуальным вопросом, о котором необходимо помнить и который необходимо решать в рамках трансляционных исследований. Клеточная терапия является серьезным вмешательством, имеющим свои потенциальные негативные эффекты. Решение об оправданности проведения клеточной терапии должно приниматься с учетом всех возможных положительных и негативных последствий.
Заключение
Клеточные технологии – перспективный метод современной регенеративной медицины. В настоящий момент большое количество научных фактов свидетельствует в пользу эффективности их применения для терапии тяжелых форм заболеваний сердечно-сосудистой, нервной, эндокринной и опорно-двигательной систем. Однако еще не решены многие проблемы этического характера, вопросы лицензирования клеточных технологий, также существует серьезный риск осложнений при лечении стволовыми клетками [27]. Несмотря на это клеточные технологии уже являются неотъемлемой и крайне перспективной составляющей современной медицины.
Список литературы
1. Киселев А.В., Сахнов С.Н., Заболотний А.Г., Калинина Н.Ю. Клеточные технологии, клеточная терапия в офтальмологии - состояние и перспективы. Современные проблемы науки и образования. 2018;(5):202-202 [Kiselev A.V., Sakhnov S.N., Zabolotniy A.G., Kalinina N.Y. Cell technologies, cell therapy in ophthalmology - state and prospective. Modern problems of science and education. 2018;(5):202-202 (In Russian)]. URL: https://science-education.ru/ru/article/view?id=28062 [дата доступа: 29.04.2025].
2. Обухов Д.К. Биология и медицина на рубеже XX-XXI в. Биология в школе. 2017;7:3-12 [Obukhov D.K. Biology and medicine at the turn of the XX-XXI centuries. Biology in school. 2017;7:3-12 (In Russian)]. URL: http://www.schoolpress.ru/products/rubria/index.php?ID=79964&SECTION_ID=20 [дата доступа: 29.04.2025].
3. Богданов В.Р. От цитобласта до генома (к 170-летию создания клеточной теории). Медицина в Кузбассе. 2007;3:3-6 [Bogdanov V.R. From cytoblast to genome (on the 170th anniversary of the creation of cell theory). Medicine in Kuzbass. 2007;3:3-6 (In Russian)]. URL: https://cyberleninka.ru/article/n/ot-tsitoblasta-do-genoma-k-170-letiyu-sozdaniya-kletochnoy-teorii [дата доступа: 29.04.2025].
4. Павлова В.Н. История открытия стволовых клеток крови. Аллея науки. 2020;1(12): 300-303 [Pavlova V.N. History of the discovery of blood stem cells. Alley of Science. 2020; 1(12): 300-303 (In Russian)]. URL: https://alley-science.ru/domains_data/files/3December2020/ISTORIYa%20OTKRYTIYa%20STVOLOVYH%20KLETOK%20KROVI.pdf [дата доступа: 29.04.2025].
5. Деев Р.В. Профессор Александр Александрович Максимов: эволюция идей. Гены и Клетки. 2014;9(2):6-14 [Deev R.V. Professor Alexander Alexandrovich Maksimov: evolution of ideas. Genes and Cells. 2014;9(2):6-14 (In Russian)]. URL: https://cyberleninka.ru/article/n/professor-aleksandr-aleksandrovich-maksimov-evolyutsiya-idey [дата доступа: 29.04.2025].
6. Бабичева Е. Опережая свой век: русский ученый – у истоков открытия стволовых клеток. Интернет ресурс [Babicheva E. Ahead of her time: Russian scientist at the origins of the discovery of stem cells. Internet resource (In Russian)]. URL: https://blood5.ru/knowledge/operezhaya-svoj-vek-russkij-uchenyj-u-istokov-otkrytiya-stvolovyx-kletok/ [дата доступа: 29.04.2025].
7. Макаревич П.И. Три десятилетия развития генной терапии: вехи и перспективы. Регенерация органов и тканей. 2023;1(1):16-24 [Makarevich P.I. Three decades of gene therapy development: milestones and prospects. Regeneration of organs and tissues. 2023;1(1):16-24 (In Russian)]. https://doi.org/10.60045/2949-5958-2025-1-16-24
8. Anguela X.M. Entering the modern era of gene therapy. Annual Review of Medicine. 2019;(70):273-288. https://doi.org/10.1146/annurev-med-012017-043332
9. Ляпун И.Н., Андрюков Б.Г., Бынина М.П. Культура клеток hela: бессмертное наследие Генриетты Лакс. Молекулярная генетика, микробиология и вирусология. 2019;37(4):151 15 [Lyapun I.N., Andryukov B.G., Bynina M.P. HeLa cell culture: Henrietta Lacks immortal heritage. Molecular Genetics, Microbiology and Virology. 2019;37(4):151 157 (In Russian)]. https://doi.org/10.17116/molgen201937041151
10. Зорин В.Л., Зорина А.И. К 90-летию Александра Яковлевича фриденштеина. Гены и клетки. 2014;9(3):8-10 [Zorin V.L., Zorina A.I. To the 90th year of Alexandr Jakovlevich Friedenstein. Genes & Cells. 2014;9(3):8-10 (In Russian)]. https://doi.org/10.23868/gc120254
11. О биомедицинских клеточных продуктах. Федеральный закон от 23.06.2016 № 180-ФЗ [On biomedical cell products. Federal Law of 23.06.2016 No. 180-FZ (In Russian)]. URL: http://pravo.gov.ru/proxy/ips/?docbody=&vkart=card&nd=102402596&rdk= [дата доступа: 29.04.2025].
12. Kolios G., Moodley Y. Introduction to stem cells and regenerative medicine. Respiration. 2013;85(1):3-10. https://doi.org/10.1159/000345615
13. Abou-Saleh, H., Zouein, F.A., El-Yazbi, A. et al. The march of pluripotent stem cells in cardiovascular regenerative medicine. Stem Cell Res Ther. 2018;9 (201). https://doi.org/10.1186/s13287-018-0947-5
14. Tkemaladze J. Replicative Hayflick Limit. Longevity Horizon. 2025; 1(2). https://doi.org/10.5281/zenodo.14752664
15. He Y., Wang Y., Liu B. et al. Structures of telomerase at several steps of telomere repeat synthesis. Nature . 2021;593:454–459. https://doi.org/10.1038/s41586-021-03529-9
16. Лопатина ТВ. Новые данные в изучении генетических механизмов поддержания «стволовости» в эмбриональных стволовых клетках человека. Гены и Клетки. 2023;(1):8-10 [Lopatina TV. New data in the study of genetic mechanisms for maintaining "stemness" in human embryonic stem cells. Genes & Cells. 2023;(1):8-10 (In Russian)]. https://doi.org/10.23868/gc121867
17. Силаева Н.В. Ниши стволовых клеток. Синергия Наук. 2017;(18);958-966 [Silaeva N.V. Stem cell niches. Synergy of Sciences. 2017;(18);958-966 (In Russian)]. URL: http://synergy-journal.ru/archive/article1356 [дата доступа: 29.04.2025].
18. Miller F.D., Gauthier-Fisher A. Home at last: neural stem cell niches defined. Cell Stem Cell. 2009;4(6):507-10. https://doi.org/10.1016/j.stem.2009.05.008.
19. Суханов Ю.С. Гаврилов Олег Константинович, инициатор нового направления клинической трансфузиологии - гравитационной хирургии крови. Вестник службы крови России. 2016;1: 1-6 [Sukhanov Yu.S. Gavrilov Oleg Konstantinovich, initiator of a new direction in clinical transfusiology - gravitational blood surgery. Bulletin of the Blood Service of Russia. 2016;1:1-6 (In Russian)]. URL: https://www.elibrary.ru/item.asp?id=25993609 [дата доступа: 29.04.2025].
20. Хлусов И. А. Вопросы клеточных технологий и биоинженерии тканей (обзор). Journal of Siberian Federal University. Biology. 2008;3(1):269-294 [Khlusov I. A. Issues of cellular technologies and tissue bioengineering (review). Journal of Siberian Federal University. Biology. 2008;3(1):269-294 (In Russian)]. URL: http://elib.sfu-kras.ru/bitstream/handle/2311/939/06_%D0%A5%D0%BB%D1%83%D1%81%D0%BE%D0%B2.pdf?sequence=1&ysclid=ma39pxzz38626575600 [дата доступа: 29.04.2025].
21. Михаленко Е.П., Щаюк А.Н., Кильчевский А.В. Сигнальные пути: механизм регуляции пролиферации и выживаемости опухолевых клеток. Молекулярная и прикладная генетика. 2019;26:145-157 [Mikhalenko E.P., Shchayuk A.N., Kilchevsky A.V. Signaling pathways: mechanism of regulation of proliferation and survival of tumor cells. Molecular and Applied Genetics. 2019;26:145-157 (In Russian)]. URL: https://cyberleninka.ru/article/n/signalnye-puti-mehanizm-regulyatsii-proliferatsii-i-vyzhivaemosti-opuholevyh-kletok [дата доступа: 29.04.2025].
22. Forostyak O., Dayanithi G., Forostyak S. CNS Regenerative Medicine and Stem Cells. Opera Medica et Physiologica 2016;2(1):55–62. https://doi.org/20388/OMP2016.001.0023
23. Mallat Z., Fornes P., Costagliola R. et al. Age and gender effects on cardiomyocyte apoptosis in the normal human heart. J Gerontol A Biol Sci Med Sci. 2001;56(11):719-23. https://doi.org/10.1093/gerona/56.11.m719
24. Dzhauari S., Basalova N., Primak A. et al. The Secretome of Mesenchymal Stromal Cells in Treating Intracerebral Hemorrhage: The First Step to Bedside. Pharmaceutics. 2023; 15(6):1608. https://doi.org/10.3390/pharmaceutics15061608
25. Абаева В.А., Абдуллаев Р.М., Агаева М. В. Достижения и методы ткане- и органогенеза в клеточных технологиях. Молодой ученый. 2020;50(340):371-373 [Abaeva V.A., Abdullaev R.M., Agaeva M.V. Achievements and methods of tissue and organogenesis in cellular technologies. Young scientist. 2020;50(340):371-373 (In Russian)]. URL: https://moluch.ru/archive/340/76425/ [дата доступа: 29.04.2025].
26. Нимер С.Н. Стволовые клетки (обзор литературы). Проблемы здоровья и экологии. 2009;1(19) [Nimer S.N. Stem cells (literature review). Problems of health and ecology. 2009;1(19) (In Russian)]. URL: https://cyberleninka.ru/article/n/stvolovye-kletki-obzor-literatury [дата доступа: 29.04.2025].
27. Yu J., Vodyanik M.A., Smuga-Otto K. et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 2007;318(5858):1917-20. https://doi.org/ 10.1126/science.1151526
28. Щербакова Т.Н., Еремина А.И., Второва М.А. Инновационные клеточные технологии с позиций доказательной медицины. Фармация и фармакология. 2015;3(3(10)):69-71 [Scherbakova T.N., Eryomina A.I., Vtorova M.A. Innovative cellular technologies from the perspective of evidentiary medicine. Pharmacy & Pharmacology. 2015;3(3(10)):69-71 (In Russian)]. https://doi.org/10.19163/2307-9266-2015-3-3(10)-69-71
29. Iismaa S.E., Kaidonis X., Nicks A.M. et al. Comparative regenerative mechanisms across different mammalian tissues. NPJ Regen Med. 2018;3:6. https://doi.org/10.1038/s41536-018-0044-5
30. Bergmann O., Spalding K.L., Frisén J. Adult Neurogenesis in Humans. Cold Spring Harb Perspect Biol. 2015;7(7):a018994. https://doi.org/10.1101/cshperspect.a018994
31. Sun D. The potential of endogenous neurogenesis for brain repair and regeneration following traumatic brain injury. Neural Regen Res. 2014;9(7):688-92. https://doi.org/10.4103/1673-5374.131567
32. Melo-Narváez M.C., Stegmayr J., Wagner D.E., Lehmann M. Lung regeneration: implications of the diseased niche and ageing. Eur Respir Rev. 2020; 29(157):200222. https://doi.org/10.1183/16000617.0222-2020
33. Лызиков А. Н., Скуратов А. Г., Воропаев Е. В., Призенцов А. А. Роль стволовых клеток в регенерации печени и перспективы их использования в лечении печеночной недостаточности (обзор литературы). Проблемы здоровья и экологии. 2012;(2):7-13 [Lyzikov A.N., Skuratov A.G., Voropayev E.V., Prizentsov A.A. The role of stem cells in liver regeneration and prospects of their use in the treatment of liver impairment (literature review). Health and Ecology Issues. 2012;(2):7-13 (In Russian)]. https://doi.org/10.51523/2708-6011.2012-9-2-1
34. Wang Z., Zhu S., Jia Y. et al. Positive selection of somatically mutated clones identifies adaptive pathways in metabolic liver disease. Cell. 2023;186(9):1968-1984.e20. https://doi.org/10.1016/j.cell.2023.03.014
35. Шаманская Т.В., Осипова Е.Ю., Румянцев С.А. Технологии культивирования мезенхимальных стволовых клеток ex vivo для клинического использования. Онкогематология. 2009;(3):69-76 [Shamanskaya T.V., Osipova E.Yu., Roumiantsev S.A. Mesenchymal stem cells ex vivo cultivation technologies for clinical use. Oncohematology. 2009;(3):69-76. (In Russian)]. https://doi.org/10.17650/1818-8346-2009-0-3-69-76
36. Шаманская Т.В., Осипова Е.Ю., Пурбуева Б.Б. и др. Культивирование мезенхимальных стволовых клеток Ex vivo в различных питательных средах (обзор литературы и собственный опыт). Онкогематология. 2010;(3):65-71 [Shamanskaya T.V., Osipova Ye.Yu., Purbueva B.B. et al. Ex vivo expansion of mesenchymal stem cells in different culture conditions (the literature review and own experience). Oncohematology. 2010;(3):65-71 (In Russian)]. URL: https://oncohematology.abvpress.ru/ongm/article/view/756 [дата доступа: 29.04.2025].
37. Karagyaur M., Dzhauari S., Basalova N. et al. MSC Secretome as a Promising Tool for Neuroprotection and Neuroregeneration in a Model of Intracerebral Hemorrhage. Pharmaceutics. 2021; 13(12):2031. https://doi.org/10.3390/pharmaceutics13122031
38. Lopatina T., Kalinina N., Karagyaur M. et al. Correction: Adipose-Derived Stem Cells Stimulate Regeneration of Peripheral Nerves: BDNF Secreted by These Cells Promotes Nerve Healing and Axon Growth De Novo. PLoS One. 2019;14(7):e0219946. https://doi.org/10.1371/journal.pone.0219946
39. Агладзе К.И. Клеточные технологии в регенеративной медицине сердца: основные проблемы и пути развития. Альманах клинической медицины. 2019;47(7):623-629 [Agladze K.I. Cell technologies in the regenerative medicine of the heart: main problems and ways of development. Almanac of Clinical Medicine. 2019;47(7):623-629 (In Russian)]. https://doi.org/10.18786/2072-0505-2019-47-043
40. Dababneh S.F., Babini H., Jiménez-Sábado V. et al. Dissecting cardiovascular disease-associated noncoding genetic variants using human iPSC models. Stem Cell Reports. 2025;20(4):102467. https://doi.org/10.1016/j.stemcr.2025.102467
41. Деев Р.В., Исаев А.А., Кочиш А.Ю., Тихилов Р.М. Клеточные технологии в травматологии и ортопедии: пути развития. Гены и Клетки. 2007;2(4):18-30 [Deev R.V., Isaev A.A., Kochiesh A.Y., Tikhilov R.M. Cellular Technologies in Traumatology and Orthopedics: Ways of development. Genes & Cells. 2007;2(4):18-30 (In Russian)]. https://doi.org/10.23868/gc133671
42. Аверьянов А.В., Коноплянников А.Г. Клеточные технологии в лечении заболеваний легких - есть ли перспективы? Клиническая практика. 2010;1(4):3-11 [Averyanov A.V., Konoplyannikov A.G. Cellular technologies in treatment of lung diseases - are whether prospects? Journal of Clinical Practice. 2010;1(4):3-11 (In Russian)]. https://doi.org/10.17816/clinpract143-11
43. Rakhmetova V.S., Orazbayeva A.B.. Stem cells therapy in inflammatory bowel disease (in Russian). J Clin Med Kaz. 2017;4(46):6-10. https://doi.org/10.23950/1812-2892-JCMK-00463
44. Помелова А.А., Солёнова Е.А., Васильева И.В., Павлова С.И. Некоторые аспекты применения клеточной терапии при лечении заболеваний глаз: проблемы и перспективы. Вопросы клинической и фундаментальной медицины. 2024; 1(2): 25–30 [Pomelova A.A., Solenova E.A., Vasilyeva I.V., Pavlova S.I. Some aspects of the use of cell therapy in the treatment of eye diseases: problems and prospects. Issues of Clinical and Fundamental Medicine. 2024; 1(2): 25–30 (in Russian)]. https://doi.org/10.30914/M13
45. Тибекина Л.М. Нейрогенез и клеточные технологии в лечении заболеваний и повреждений нервной системы. Здоровье – основа человеческого потенциала: проблемы и пути их решения. 2014;9(1):150-156 [Tibekina L.M. Neurogenesis and cellular technologies in the treatment of diseases and injuries of the nervous system. Health is the basis of human potential: problems and solutions. 2014;9(1):150-156 (in Russian)]. URL: https://cyberleninka.ru/article/n/neyrogenez-i-kletochnye-tehnologii-v-lechenii-zabolevaniy-i-povrezhdeniy-nervnoy-sistemy [дата доступа: 29.04.2025].
46. Косенко К.Н. Стволовые клетки в стоматологии (обзор литературы). Вестник стоматологии. 2011;3(76):85-88 [Kosenko K.N. Stem cells in dentistry (literature review). Herald of Dentistry. 2011;3(76):85-88 (in Russian)]. URL: https://cyberleninka.ru/article/n/stvolovye-kletki-v-stomatologii-obzor-literatury [дата доступа: 29.04.2025].
47. Полянская А.А., Гиркина Д.Б., Стерлева Е.А. и др. Биопринтинг в медицине. особенности и перспективы использования. Международный журнал прикладных наук и технологий «Integral». 2022;(1):85-103 [Polyanskaya A.A., Girkina D.B., Sterleva E.A. et al. Bioprinting in medicine. Features and prospects of use. International journal of applied sciences and technologies "Integral". 2022;(1):85-103 (in Russian)]. URL: https://cyberleninka.ru/article/n/bioprinting-v-meditsine-osobennosti-i-perspektivy-ispolzovaniya [дата доступа: 29.04.2025].
48. Семченко С.С., Колычев Н.М., Степанов С.С., Дюрягин Н.М. Перспективы использования клеточных технологий для структурно-функционального восстановления живых систем организма. Динамика систем, механизмов и машин. 2014;(6):92-95 [Semchenko S.S., Kolychev N.M., Stepanov S.S., Dyuryagin N.M. Prospects for the use of cellular technologies for structural and functional restoration of living systems of the organism. Dynamics of systems, mechanisms and machines. 2014;(6):92-95 (in Russian)]. URL: https://cyberleninka.ru/article/n/perspektivy-ispolzovaniya-kletochnyh-tehnologiy-dlya-strukturno-funktsionalnogo-vosstanovleniya-zhivyh-sistem-organizma [дата доступа: 29.04.2025].
49. Гривцова Л.Ю., Поповкина О.Е., Духова Н.Н. и др. Клеточный биобанк как необходимая инфраструктура для разработки и внедрения клеточной терапиина основе мезенхимальных стволовых клеток в комплексном лечении антрациклиновой кардиотоксичности. Обзор литературы и собственные данные. Кардиоваскулярная терапия и профилактика. 2020;19(6):2733 [Grivtsova L.Yu., Popovkina O.E., Dukhova N.N. et al. Cell biobank as a necessary infrastructure for the development and implementation of mesenchymal stem cell-based therapy in the treatment of anthracycline-induced cardiotoxicity. Literature review and own data. Cardiovascular Therapy and Prevention. 2020;19(6):2733. (In Russian)]. https://doi.org/10.15829/1728-8800-2020-2733
50. Штыров Е.М., Зотов Р.А., Лапштаева А.В. Car T-клеточная терапия как современный метод лечения онкологических заболеваний. Бюллетень науки и практики. 2019;5(5):121-127 [Shtyrov E.M., Zotov R.A., Lapshtaeva A.V. CAR T-cell Therapy as a Modern Method for the Treatment of Oncological Diseases. Bulletin of Science and Practice. 2019;5(5):121-127 (In Russian)]. https://doi.org/10.33619/2414-2948/42/16
51. Abstracts from the 57th European Society of Human Genetics (ESHG) Conference: Hybrid Posters. Eur J Hum Genet. 2024;(2):1231–1841.https://doi.org/10.1038/s41431-024-01734-4
Об авторах
Елена Анатольевна ТкачукРоссия
д.м.н., доцент, профессор кафедры генетики
Игорь Жанович Семинский
Россия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики
Максим Николаевич Карагяур
Россия
д.б.н., доцент кафедры биохимии и регенеративной биомедицины, старший научный сотрудник
Рецензия
Для цитирования:
Ткачук Е.А., Семинский И.Ж., Карагяур М.Н. КЛЕТОЧНЫЕ ТЕХНОЛОГИИ (ЛЕКЦИЯ). Байкальский медицинский журнал. 2025;4(2):92-107. https://doi.org/10.57256/2949-0715-2025-4-2-92-107
For citation:
Tkachuk E.A., Seminsky I.Zh., Karagyaur M.N. CELLULAR TECHNOLOGIES (LECTURE). Baikal Medical Journal. 2025;4(2):92-107. (In Russ.) https://doi.org/10.57256/2949-0715-2025-4-2-92-107
















