Перейти к:
ВЛИЯНИЕ ВАКУУМНОЙ ТЕРАПИИ НА ДИНАМИКУ КЛЕТОЧНЫХ РЕАКЦИЙ ПРИ МОДЕЛИРОВАНИИ ГНОЙНОГО ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У КРЫС
https://doi.org/10.57256/2949-0715-2024-4-30-39
Аннотация
Актуальность. Вакуумная терапия во всем мире применяется для лечения острой травмы, термических поражений, остеомиелита, гнойных ран, урологической патологии и др. Саногенетический эффект применения вакуум-терапии связан с воздействием измененного барометрического давления на тонус микрососудов. Вместе с тем конкретные механизмы вакуумного воздействия на течение типовых патологических процессов мало изучены.
Цель. Определить степень влияния барометрической терапии на выраженность клеточных реакций при экспериментальном гнойном воспалении.
Материал и методы. Исследованы две серии беспородных белых крыс-самцов (контрольная и опытная). В качестве модели гнойного воспаления животным под кожу бедра были имплантированы диффузионные камеры, которые заполнялись водной взвесью однодневной культуры staphylococcus aureus. Вакуумная терапия проводилась в барокамере, где поддерживали давление от 0,03 до 0,05 атмосфер. Процедуру проводили каждые сутки с экспозицией 10 минут. Материал фиксировали в 10-процентном растворе нейтрального формалина, срезы окрашивали гематоксилин эозином и по методу Ван Гизона.
Результаты. Получены морфометрические данные развития воспаления: толщина клеточного вала, соотношение нейтрофилов и макрофагов, строение клеточных структур на 1, 3, 5, 7, 10, 15-е сутки после имплантации камеры.
Заключение. Вакуум-терапия экспериментального микробного воспаления значительно сокращало длительность клеточных реакций. Улучшались миграционные, фагоцитарные, синтетические возможности клеток, участвующих в процессе воспаления. Понижение барометрического давления позволило увеличить фагоцитарную активность лейкоцитов, скорость их миграции в очаг воспаления, синтез коллагена фибробластами, взаимодействие клеток в очаге воспаления, и, следовательно, уменьшило время течения фаз воспаления в целом, препятствуя хронизации и генерализации воспалительного процесса.
Ключевые слова
Для цитирования:
Семинский И.Ж., Серебренникова С.Н., Ткачук Е.А., Васильев Ю.В. ВЛИЯНИЕ ВАКУУМНОЙ ТЕРАПИИ НА ДИНАМИКУ КЛЕТОЧНЫХ РЕАКЦИЙ ПРИ МОДЕЛИРОВАНИИ ГНОЙНОГО ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У КРЫС. Байкальский медицинский журнал. 2024;3(4):30-39. https://doi.org/10.57256/2949-0715-2024-4-30-39
For citation:
Seminsky I.Zh., Serebrennikova S.N., Tkachuk E.A., Vasiliev Yu.V. INFLUENCE OF VACUUM THERAPY ON THE DYNAMICS OF CELLULAR REACTIONS IN MODELING PURULENT INFLAMMATORY PROCESS IN RATS. Baikal Medical Journal. 2024;3(4):30-39. (In Russ.) https://doi.org/10.57256/2949-0715-2024-4-30-39
Актуальность исследования
Вакуумная терапия давно и успешно применяется для лечения широкого спектра заболеваний: острая травма, термические поражения, остеомиелит, гнойные раны, урологическая патология и другие [1, 2, 3, 4]. Считается, что саногенетический эффект от применения вакуум-терапии достигается путем воздействия измененного барометрического давления на тонус микрососудов, на механизмы транскапиллярнго обмена, на процессы жизнедеятельности патогенной микрофлоры, на интенсивность процессов перекисного окисления липидов и тканевого дыхания и др. [5, 6, 7, 8]. Декомпрессия отдельных частей тела «запускает» компенсаторно-приспособительные реакции со стороны организма, что может приводить к дополнительному лечебному эффекту вакуумной терапии [9, 10, 11, 12].
Вместе с тем конкретные механизмы вакуумного воздействия на течение типовых патологических процессов [13, 14], в том числе воспаления, требуют дальнейшей детализации [9]. В связи с этим была сформулирована цель исследования – оценить влияние барометрической терапии на интенсивность клеточных реакций при экспериментальном гнойном воспалении.
Материалы и методы
Исследование проводилось на 50 лабораторных животных (беспородные белые крысы-самцы), масса которых составила 180-220 г. Исследование было проведено в осенне-зимний период. Содержание животных и постановка экспериментов проводилась в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 года и № 267 МЗ РФ от 19.06.2003 года, а также международных правил «Guide for the Careand Use of Laboratory Animals» и соответствовали «Правилам проведения работ с использованием экспериментальных животных», «Контролю за проведением работ с использованием экспериментальных животных» (приказ № 742 и № 48 Министерства высшего и среднего специального образования СССР от 13.11.1984 года и от 23.01.1985 года) и «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 18.03.1986 года) Животные содержались в условиях вивария, эксперимент проводился в соответствии с правилами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 года № 755). Все оперативные вмешательства проводились в асептических условиях.
Для проведения исследования животных распределили по 2 сериям: контрольная и опытная серии. Всем животным под легким эфирным наркозом для моделирования гнойного воспаления имплантировали под кожу бедра диффузионные камеры собственной конструкции (патент № 5030684(010989) от 04.03.92), заполненные водной взвесью однодневной культуры staphylococcus aureus № 9198 в дозе 100 тыс. микробных тел на 1 камеру (рис.1).
Рис.1. Введение капсулы со стафилококком под кожу крысы
Вакуумную терапию проводили в опытной группе, где при помощи барокамеры собственной конструкции (рис. 2) поддерживалось давление 0,03–0,05 атмосфер. Процедуру проводили каждые сутки с экспозицией 10 минут.

Рис. 2. Барокамера для вакуумной терапии
Биологический материал забирали через 1, 3, 5, 7, 10, 15-е суток после имплантации. Материал фиксировали в 10-процентном растворе нейтрального формалина, подвергали стандартной гистологической обработке, далее заливали в парафин, готовили срезы толщиной 7 мкм и окрашивали гематоксилин-эозином и по Ван-Гизону.
По разработанной методике (Семинский И.Ж., Клейн К.Л., Дедюх А.В., 1991 г.) на светооптическом уровне в очаге воспаления вокруг камер морфологически оценивали клеточные реакции и их динамику. Так была проведена количественная регистрация толщины лейкоцитарного вала и концентрация в нем клеток, соотношение клеточных популяций, толщина фибробластической капсулы вокруг лейкоцитарного вала, а также число слоев фибробластов и концентрация фибробластов в капсуле.
Качественная регистрация проводилась и в периферической зоне очага воспаления. Оценивалось состояние микрососудов, концентрация тучных клеток, эозинофилов, нейтрофилов, мононуклеаров и малодифференцированных фибробластов. Данные были обработаны стандартными методами вариационной статистики и считались достоверными при р ≤ 0,05.
Результаты исследования
Клеточные реакции в очаге экспериментального воспаления, вызванного золотистым стафилококком (контроль)
После введения камер со взвесью стафилококка в очаг воспаления через сутки толщина клеточного вала вокруг камеры составляла 184±23 мкм с концентрацией клеток 26,8±1,1 на 1000 мкм2 (рис. 3, 4). В клеточном вале преобладали нейтрофилы, а соотношение нейтрофил: макрофаг составило 3:1.
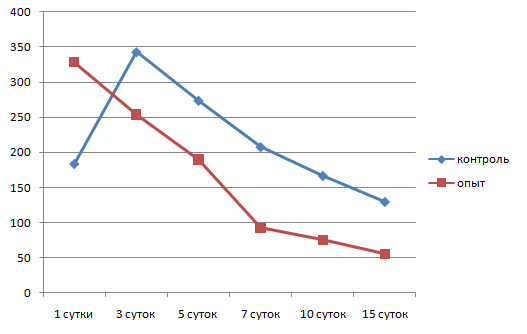
Рис. 3. Динамика толщины лейкоцитарного вала вокруг камеры
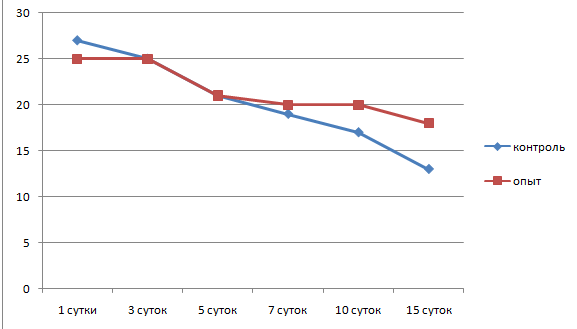
Рис. 4. Динамика плотности лейкоцитов в очаге воспаления
Наблюдали активный фагоцитоз, а около трети нейтрофилов находилась в состоянии распада и аутолиза. Макрофаги находились в основном по периферии лейкоцитарного вала. Имели место значительное отложение фибрина и отек соединительной ткани (рис.5).
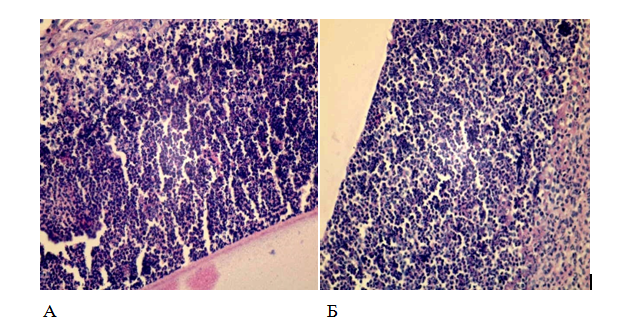
Рис. 5. Лейкоцитарный вал вокруг стенки камер со стафилококком.
А – без применения барокамеры (3 сутки)
Б – с применением барокамеры (1 сутки)
Увеличение 400, окраска гематоксилин-эозин.
По периферии очага воспаления отмечалась миграция лейкоцитов (соотношение нейтрофил: моноцит = 1:1), отек, периваскулярная инфильтрация, отложение нитей фибрина. Количество малодифференцированных фибробластов нарастало и составляло 2,1 ± 0,6 на 1000 мкм2. Непосредственно у стенки камеры образовался нейтрофильный детрит.
На 3 сутки толщина клеточного вала вокруг камеры составила 343,8±46,1 мкм с плотностью клеток 24,7±1,3 на 1000 мкм2. Соотношение нейтрофил: макрофаг представляло 1:1, происходила массовая гибель нейтрофилов в вале, которая сопровождалась фагоцитированием их макрофагами (рис.5).
В отдаленной зоне в этот же период наблюдалось расширение и полнокровие сосудов, периваскулярная инфильтрация, преобладание моноцитов над нейтрофилами. Концентрация лейкоцитов составляла 8,1±1,1 на 1000 мкм2, а также продолжилось накопление малодифференцированных фибробластов. По краю лейкоцитарного вала появилась тонкая фибробластическая капсула толщиной 157,5±12,5 мкм, состоящая из 3–4 рядов параллельно ориентированных фибробластов. Плотность фибробластов составляла 3,1±0,3 на 1000 мкм2 (рис. 6, 7, 8, 9).
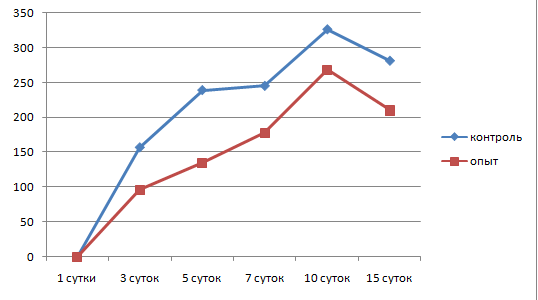
Рис.6. Динамика толщины фибробластической капсулы вокруг камеры
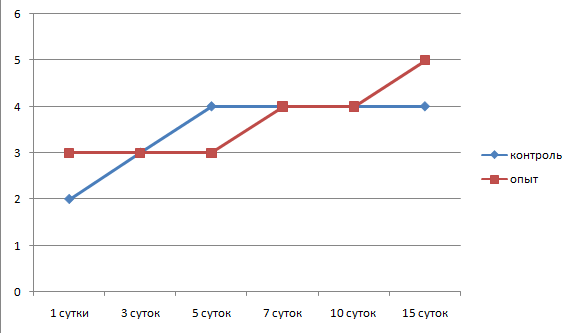
Рис. 7. Динамика плотности фибробластов в очаге воспаления
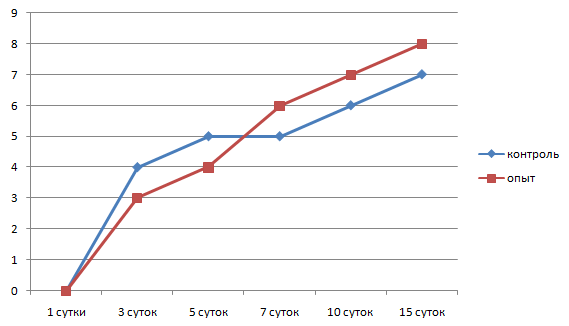
Рис. 8. Динамика рядов фибробластов вокруг камеры
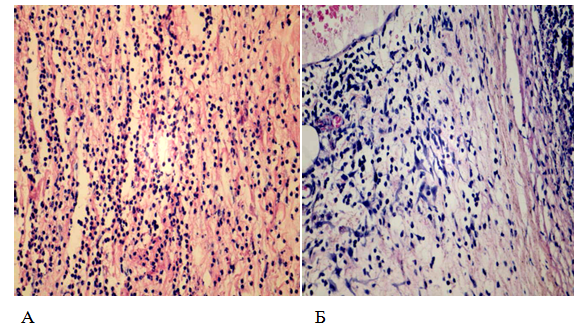
Рис. 9. Периферическая зона очага воспаления
А – без применения барокамеры (3 сутки)
Б – с применением барокамеры (3 сутки)
Увеличение 400, окраска гематоксилин-эозин.
На 5 сутки эксперимента толщина лейкоцитарного вала вокруг камер начала уменьшаться и составила 274,4±41,6 мкм, плотность лейкоцитов в вале также снижалась и составляла 20,9±0,6 на 1000 мкм2. Большая часть нейтрофилов была разрушена, макрофаги активно фагоцитировали погибшие нейтрофилы. Соотношение нейтрофил: макрофаг представляло 1:2. В периферической крови наблюдалось повышение процентного уровня моноцитов и снижение процентного уровня нейтрофилов.
В целом наблюдалось чередование клеток: непосредственно к стенке камеры прилежал нейтрофильный детрит, затем располагался вал из неповрежденных лейкоцитов, с преобладанием мононуклеаров, фагоцитирующих девитализированные ткани, остатки фибрина, аутолизированные нейтрофилы.
В периферической зоне очага воспаления продолжалось формирование фибробластической капсулы, которая к этому сроку состояла из 4–5 слоев фибробластов, между которыми имелись значительные расстояния. Между фибробластами регистрировались макрофаги и лимфоциты. Толщина капсулы на этот срок составляла 239,4±21,5 мкм, плотность фибробластов была крайне низка – 3,8±0,3 на 1000 мкм2. Продолжалась сосудистая реакция, которая проявлялась в виде периваскулярной инфильтрации лейкоцитов с преобладанием моноцитов над нейтрофилами. Плотность лейкоцитов составляла 7,1±2 на 1000 мкм2.
На 7 сутки от момента введения камер толщина лейкоцитарного вала продолжала снижаться и составляла 208,7±28,4 мкм. В вале макрофаги начинали преобладать над нейтрофилами, соотношение их составляло 2:1. Также начала снижаться плотность клеточного вала до 18,9±0,7 на 1000 мкм2. Объем нейтрофильного детрита уменьшался за счет его фагоцитоза макрофагами. Макрофаги продвигались от периферии вала непосредственно к стенке камеры. В периферической крови на этот срок регистрировался повышенный уровень моноцитов по отношению к нейтрофилам.
В периферической зоне очага воспаления на 7 сутки продолжилось формирование фибробластической капсулы, ее толщина составляла 245±37,8 мкм с числом рядов фибробластов 4,4±1. Большинство фибробластов были малодифференцированными, а синтез коллагена проходил слабо. Плотность фибробластов была равна 4,4±0,3 на 1000 мкм2. Лейкоциты этой зоны на 90 % были представлены моноцитами с плотностью 7,5±1,7 на 1000 мкм2, которые мигрировали в сторону инородного тела.
10 сутки отмечены значительным снижением объема клеточного вала, толщина которого составляла 167±11 мкм. Плотность клеток также снизилась, по сравнению с предыдущим сроком, до 16,8 ± 0,5 на 1000 мкм2. Соотношение клеток в вале составляло 3:1 с преобладанием макрофагов.
Продолжалось образование фибробластической капсулы по периферии клеточного вала, толщина ее увеличилась до 326,3±60,2 мкм, хотя плотность фибробластов осталась на прежнем уровне и составляла 4,2±0,3 на 1000 мкм2, а число слоев фибробластов увеличилось до 6,5±2.
В отдаленной зоне снизилась сосудистая реакция, интенсивность диапедеза и уменьшалась инфильтрация. Клеточные формы лейкоцитов в основном были представлены моноцитами, плотность которых составляла 5,2±0,5 на 1000 мкм2. Признаков отека и отложений фибрина не наблюдалось.
Через 15 суток от начала воспаления толщина лейкоцитарного вала вокруг камер со стафилококком продолжала снижаться и составляла 130±9,1 мкм. Макрофаги преобладали среди клеточных элементов лейкоцитарного вала и представляли 70 %. Плотность клеток в вале снижалась до 13,9±0,1 на 1000 мкм2. Клетки лежали свободно, интенсивность фагоцитоза несколько уменьшилась. Оставалось незначительное количество деградированных нейтрофилов, свободно лежащих стафилококков не регистрировалось. Вокруг клеточного вала регистрировалась рыхлая фибробластическая капсула толщиной 281,3±4,8 мкм, состоящая из 5–6 слоев фибробластов с плотностью клеток 4,1±0,3 на 1000 мкм2 (рис.10).
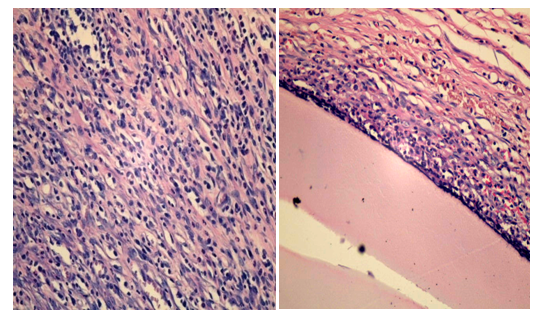
Рис. 10. Фибробластическая капсула вокруг стенки камер
А – без применения барокамеры (15 сутки)
Б – с применением барокамеры (15 сутки)
Увеличение 400, окраска гематоксилин-эозин.
Периферическая зона очага воспаления практически соответствовала норме, реакций со стороны сосудов не наблюдалось, было несколько повышено содержание в этой зоне лейкоцитов, в основном моноцитов, плотность которых составляла 4,5±0,3 на 1000 мкм2.
Показатели клеточных реакций в очаге экспериментального воспаления, вызванного золотистым стафилококком с применением барокамеры
|
Через сутки от момента введения камер со стафилококком на фоне измененного барометрического давления вокруг них сформировался лейкоцитарный вал толщиной 328±70 мкм. Концентрация клеток в вале составляла 25,4±0,8 клетки на 1000 мкм2. Соотношение клеточных форм нейтрофил: макрофаг = 5:1. Клетки лежали плотно, наблюдался фагоцитоз нейтрофилами стафилококков, разрушенных фрагментов соединительной ткани и фибрина. Часть нейтрофилов дегранулировала, регистрировались фрагменты разрушенных нейтрофилов. Небольшое количество макрофагов окружало нейтрофильный вал. Они залегали более свободно, наблюдался фагоцитоз макрофагами фибриновых нитей. Зона очага воспаления была отечна.
Регистрировалась выраженная сосудистая реакция подкожной соединительной ткани: вазодилатация, полнокровие микрососудов, диапедез лейкоцитов и их периваскулярная инфильтрация. Плотность клеток составляла 6,6±1,1 на 1000 мкм2 с преобладанием моноцитов, которые мигрировали в сторону камеры. Наблюдалось накопление малодифференцированных фибробластов, концентрация их составляла 2,5±0,3 на 1000 мкм2.
На 3 сутки после введения нами камер со стафилококком на фоне лечения барокамерой толщина лейкоцитарного вала составляла 254±33,7 мкм, плотность клеток в вале продолжала оставаться высокой 25,1±1,5 на 1000 мкм2. Соотношение нейтрофил : макрофаг было 1:1. Большая часть нейтрофилов находилась в стадии деградации, основной фагоцитирующей клеткой стал макрофаг. Свободно лежащих колоний стафилококка не обнаруживалось. Степень отечности и количество отложений фибрина снизилось. По периферии очага воспаления на границе с лейкоцитарным валом появилась тонкая соединительнотканная капсула, состоящая из 3±0,3 слоев фибробластов, толщиной 96±13,7 мкм с плотностью клеток 3±0,5 на 1000 мкм2. Фибробласты ориентировались в параллельные ряды, контактировали отростками, регистрировалось незначительное количество коллагеновых волокон.
В отдаленной зоне очага воспаления снижалась интенсивность сосудистой реакции, большинство сосудов приходило в нормальное состояние, уменьшалась интенсивность диапедеза лейкоцитов и периваскулярной инфильтрации. В соединительной ткани имелось небольшое количество лейкоцитов, большинство из которых было представлено моноцитами. В этой же зоне регистрировались малодифференцированные фибробласты, плотность которых составляла 3,1±0,6 на 1000 мкм2.
Через 5 суток от начала воспаления около стенки камер сохранялся лейкоцитарный вал толщиной 190±48 мкм, плотность клеток закономерно снижалась до 21,1±2,4 на 1000 мкм2. Практически все нейтрофилы были разрушены с образованием детрита, состоящего из фрагментов клеток, которые фагоцитировались макрофагами. Макрофаги значительно преобладали над нейтрофилами с соотношением 1:3 в пользу макрофагов. Основной фагоцитирующей клеткой в очаге воспаления становился макрофаг. В фаголизосомах регистрировались все стадии фагоцитоза.
В периферической зоне очага воспаления сосудистая реакция снижалась по сравнению с предыдущим сроком. Плотность лейкоцитов, лежащих вне сосудов, составляла 5,8±1 клеток на 1000 мкм2, 90 % из них было представлено макрофагами, 10 % – нейтрофилами. Вокруг клеточного вала продолжала образовываться фибробластическая капсула толщиной 135±45 мкм. Капсула имела 4–5 рядов фибробластов, которые ориентировались в параллельные ряды вдоль длиной оси, плотность фибробластов составляла 3,3±0,4 клеток на 1000 мкм2. Синтезированные коллагеновые волокна лежали свободно, внеклеточный матрикс (гликозаминогликаны) в виде аморфного вещества заполнял пространство между фибробластами и коллагеном.
На 7 сутки от начала воспалительного процесса при измененном барометрическом давлении в зоне очага воспаления сохранялся клеточный вал толщиной 93,6±30,6 мкм с плотностью клеток 19,9±1,1 на 1000 мкм2, 90 % которых было зрелыми макрофагами с практически прежней активностью: осуществляли фагоцитоз нейтрофилов, продуктов деградации соединительной ткани. Свободно лежащих колоний стафилококка не регистрировалось. Соединительнотканная капсула вокруг инородного тела закономерно модифицировалась: становилась более зрелой, нарастало число слоев фибробластов (6–7), усиливался синтез коллагена и гликозаминогликанов. Толщина ее на этот срок составляла 178±17,5 мкм с плотностью клеток 4±0,4 на 1000 мкм2. Большинство фибробластов в вале синтезировало компоненты основного вещества соединительной ткани, преимущественно нити коллагена. В фибробластической капсуле сохранялось незначительное количество моноцитов с плотностью 4,8±1,1 на 1000 мкм2.
Через 10 суток от момента введения камер со стафилококком на фоне лечения барокамерой вокруг них еще имелся клеточный лейкоцитарный вал, толщина которого резко снижалась до 76±16 мкм. Большая часть клеточных форм была представлена фагоцитирующими макрофагами с плотностью 20,2±1,3 на 1000 мкм2. Уменьшался объем нейтрофильного детрита, микробные тела стафилококка визуально не обнаруживались. По периметру клеточного вала располагалась формирующаяся фибробластическая капсула с максимальной толщиной 268,3±46,2 мкм. Капсула имела признаки незрелости, число параллельно ориентированных рядов фибробластов составляло 7±1,8, плотность клеток – 4,2±0,6 на 1000 мкм2. Плотность лейкоцитов в этой зоне снижалась, по сравнению с предыдущим сроком, и составляла 4±0,8 на 1000 мкм2. Подлежащая подкожная соединительная ткань не отличалась от нормальной.
Через 15 суток от начала воспалительного процесса толщина лейкоцитарного вала вокруг стенки камер резко снизилась до 56 ±11 мкм, также снизилась плотность клеток, которая составляла на этот срок 18,4±1,1 клеток на 1000 мкм2. Клеточный состав вала был представлен практически одними макрофагами. Интенсивность фагоцитарной реакции макрофагов замедлялась, в фаголизосомах оставались непереваренные фрагменты нейтрофилов, стафилококка, фибрина, меньше регистрировалось фигур захвата.
Толщина фибробластической капсулы вокруг клеточного вала незначительно снижалась, по сравнению с предыдущим сроком, за счет созревания и уплотнения и составляла 210,8±31 мкм. Плотность фибробластов была 4,7±0,6 на 1000 мкм2, число слоев фибробластов 7–8. Синтетический аппарат фибробластов был активирован, объем вновь синтезированного коллагена преобладал над объемом бесструктурного вещества соединительной ткани (гликозаминогликаны, протеогликаны, др.). Обращает внимание обилие вновь образованных капилляров, которые прорастают внутрь рубцовой ткани. Внутри капсулы практически не осталось свободно лежащих моноцитов, наблюдались единичные капилляры. Подкожная клетчатка зоны воспаления имела обычное строение.
Обсуждение
Таким образом, моделирование микробного воспаления показало затягивание всех клеточных фаз, наложение их друг на друга, при этом полноценного формирования фиброзной капсулы вокруг инородного тела не произошло. Это было интерпретировано как тенденция к хронизации воспалительного процесса. Лейкоцитарная фаза протекала до 7 суток, на нее накладывалась макрофагическая, которая завершилась лишь к 15 суткам. Фибробластическая стадия протекала параллельно макрофагической и полностью не закончилась на 15 сутки. Клетки, реализующие воспаление, недостаточно полно осуществляют свои основные функции, снижены все реакции нейтрофилов, макрофагов, фибробластов, особенно фагоцитарная и синтетическая, что связано с патогенным действием токсинов и структурных компонентов стафилококка.
При использовании баротерапии толщина фибробластической капсулы вокруг клеточного вала незначительно снижалась, а плотность фибробластов была значительной и составила 4,7±0,6 на 1000 мкм2, с 7–8 слоями фибробластов. Синтетический аппарат фибробластов был активирован, объем вновь синтезированного коллагена преобладал над объемом бесструктурного вещества соединительной ткани (гликозаминогликаны, протеогликаны, др.). Обращает внимание обилие вновь образованных капилляров, которые прорастают внутрь рубцовой ткани при баротерапии. Внутри капсулы практически не осталось свободно лежащих моноцитов, наблюдались единичные капилляры. Подкожная клетчатка зоны воспаления имела обычное строение. Морфологическими признаками противовоспалительного эффекта при вакуумной терапии можно считать:
- последовательную и быструю смену клеточных фаз в очаге воспаления (лейкоцитарная фаза – макрофагическая фаза – фибробластическая фаза);
- оптимальный объем лейкоцитарного вала и фибробластической капсулы в очаге воспаления;
- интенсивный фагоцитоз стафилококка макрофагами;
- хорошее кровоснабжение рубцовой ткани;
- относительно «нормальное» состояние периферической зоны очага воспаления (слабая инфильтрация лейкоцитами, мало выраженная сосудистая реакция, небольшой отек и незначительное количество фибрина).
В случае вакуум-терапии наблюдался более благоприятный исход воспаления.
Заключение
При моделировании экспериментального микробного воспалительного процесса на фоне вакуум-терапии значительно сокращается длительность клеточных реакций по сравнению со стафилококковым воспалительным процессом, наблюдается улучшение миграционных, фагоцитарных, синтетических возможностей клеток, реализующих процесс воспаления, что препятствовало хронизации воспаления. Несмотря на то, что токсины стафилококка, приводили к затягиванию всех фаз воспаления, по сравнению с асептическим воспалением, пониженное барометрическое давление увеличило фагоцитарную активность лейкоцитов, скорость их миграции в очаг воспаления, синтез коллагена фибробластами, взаимодействие клеток в очаге воспаления, и, следовательно, уменьшало время течения фаз процесса и воспаления в целом, препятствуя хронизации и генерализации воспаления.
Список литературы
1. Давыдов Ю.А., Ларичев Л.Б. Вакуум-терапия ран и раневой процесс. М.: Медицина; 1999 [Davydov Yu.A., Larichev L.B. Vacuum therapy of wounds and the wound process. Moscow: Medicine; 1999 (In Russian)].
2. Михайличенко П.П. Вакуум-терапия: Баночный массаж. СПб.: Невский проспект; 2000 [Mikhailichenko P.P. Vacuum therapy: Cupping massage. St. Petersburg: Nevsky Prospect; 2000 (In Russian)].
3. DeFranzo A.J., Argenta L.C., Marks M.W. et al. The use of vacuum-assisted closure therapy for the treatment of lower-extremity wounds with exposed bone. Plast Reconstr Surg. 2001;108(5):1184-1191. DOI:10.1097/00006534-200110000-00013
4. Kirby J.P., Fantus R.J., Ward S. et al. Novel uses of a negative-pressure wound care system. J Trauma. 2002;53(1):117-121. DOI:10.1097/00005373-200207000-00024
5. Saxena V., Hwang C.W., Huang S. et al. Vacuum-assisted closure: microdeformations of wounds and cell proliferation. Plast Reconstr Surg. 2004;114(5):1086-1098. DOI:10.1097/01.prs.0000135330.51408.97
6. Будкевич Л.И., Безуглова Т.В., Зайцева Т.В. и др. Потенциал вакуумной терапии в лечении новорожденного с тяжелым термическим поражением. Российский вестник перинатологии и педиатрии. 2015;60(4):115-118 [Budkevich L.I., Bezuglova T.V., Zaitseva T.V. et al. The potential of vacuum therapy in the treatment of a newborn infant with severe thermal injury. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2015;60(4):115-118 (In Russian)]. URL: https://www.ped-perinatology.ru/jour/article/view/145 [дата доступа: 12.11.2024].
7. Schintler MV. Negative pressure therapy: theory and practice. Diabetes Metab Res Rev. 2012;28 Suppl 1:72-77. DOI:10.1002/dmrr.2243
8. Willy C., ed. The theory and practice of vacuum therapy. Germany: Lindqvist Book-Publishing; 2006. URL: https://www.researchgate.net/publication/332258793_The_Theory_and_Practice_of_Vacuum_Therapy_-_Willy_ed#fullTextFileContent [accessed: 12.11.2024]
9. Back D.A., Scheuermann-Poley C., Willy C. Recommendations on negative pressure wound therapy with instillation and antimicrobial solutions - when, where and how to use: what does the evidence show?. Int Wound J. 2013;10 Suppl 1(Suppl 1):32-42. DOI:10.1111/iwj.12183
10. Оболенский В.Н., Ермолов А.А., Сычев Д.В. и др. Метод локального отрицательного давления в профилактике и лечении гнойно-септических осложнений в травматологии и ортопедии. Вестник травматологии и ортопедии им. Н.Н. Приорова. 2013;20(2):3-11 [Obolenskiy V.N., Ermolov A.A., Sychyev D.V. et al. Negative Pressure Wound Therapy for Prevention and Treatment of Purulent Septic Complications in Traumatology and Orthopedics. N.N. Priorov Journal of Traumatology and Orthopedics. 2013;20(2):3-11 (In Russian)]. DOI: 10.17816/vto2013023-11
11. Morykwas M.J., Simpson J., Punger K. et al. Vacuum-assisted closure: state of basic research and physiologic foundation. Plast Reconstr Surg. 2006;117(7 Suppl):121S-126S. DOI:10.1097/01.prs.0000225450.12593.12
12. Stent G.S. Prematurity and uniqueness in scientific discovery. Sci Am. 1972;227(6):84-93. DOI: 10.1038/scientificamerican1272-84
13. Augustin M., Herberger K. Nutzen und Grenzen der Vakuumtherapie von Wunden [Benefits and limitations of vacuum therapy in wounds]. Hautarzt. 2007;58(11):945-951. DOI:10.1007/s00105-007-1422-x
14. Reddy A.J., Tak N., Nawathey N. et al. Treatment of a Rare Case of Orbital Necrotizing Fasciitis Utilizing Negative Pressure Wound Therapy. Cureus. 2021;13(10):e18682. DOI:10.7759/cureus.18682
Об авторах
Игорь Жанович СеминскийРоссия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики
Светлана Николаевна Серебренникова
Россия
к.м.н., доцент кафедры патологической физиологии и клинической лабораторной диагностики
Елена Анатольевна Ткачук
Россия
д.м.н., доцент, профессор кафедры патологической физиологии и клинической лабораторной диагностики, ФГБОУ ВО ИГМУ Минздрава России, Россия, 664003, г. Иркутск, ул. Красного Восстания, 1; старший научный сотрудник, ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека», Россия, 664003, г. Иркутск, ул. Тимирязева, 16; ведущий научный сотрудник ФГБНУ «Восточно-Сибирский институт медико-экологических исследований», Россия, 665826, г. Ангарск, микрорайон 12а, дом 3
Юрий Васильевич Васильев
Россия
д.м.н., профессор
Рецензия
Для цитирования:
Семинский И.Ж., Серебренникова С.Н., Ткачук Е.А., Васильев Ю.В. ВЛИЯНИЕ ВАКУУМНОЙ ТЕРАПИИ НА ДИНАМИКУ КЛЕТОЧНЫХ РЕАКЦИЙ ПРИ МОДЕЛИРОВАНИИ ГНОЙНОГО ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У КРЫС. Байкальский медицинский журнал. 2024;3(4):30-39. https://doi.org/10.57256/2949-0715-2024-4-30-39
For citation:
Seminsky I.Zh., Serebrennikova S.N., Tkachuk E.A., Vasiliev Yu.V. INFLUENCE OF VACUUM THERAPY ON THE DYNAMICS OF CELLULAR REACTIONS IN MODELING PURULENT INFLAMMATORY PROCESS IN RATS. Baikal Medical Journal. 2024;3(4):30-39. (In Russ.) https://doi.org/10.57256/2949-0715-2024-4-30-39
















