Перейти к:
НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ, ПРОТЕКАЮЩИЕ С ПОРАЖЕНИЕМ ПЕЧЕНИ (ЛЕКЦИЯ)
https://doi.org/10.57256/2949-0715-2024-1-78-95
Аннотация
Актуальность. Наследственные заболевания печени являются серьезной проблемой во всех возрастных группах. Диагностика наследственного характера нарушений со стороны печени во многих случаях оказывается затруднительной и до момента окончательного диагноза пациент успевает сменить ни одного врача и потерять время, что может привести к ухудшению течения заболевания. Поэтому вопрос своевременной диагностики наследственных заболевания печени остается до сих пор актуальным.
В лекции рассматриваются вопросы диагностики наследственных заболеваний, протекающих с поражением печени. Рассматриваются как моногенные синдромы, так и мультифакториальные заболевания. Приводятся заболевания из групп нарушений обмена цикла мочевины, аминоацидопатий и органических ацидурий, лизосомных болезней накопления, митохондриальных и пероксисомных болезней, нарушений β-окисления жирных кислот, нарушений обмена углеводов, липидов и холестерина и другие.
В работе описаны синдромы печеночных нарушений, которые встречаются при наследственных заболеваниях. Приводятся сочетания отдельных синдромов имеющих диагностическое значение. Рассмотрены патогенетические аспекты развития печеночных проявлений наследственных заболеваний.
Заключение. Симптомы поражения печени нередко встречаются в практике любого врача. Большинство из них являются проявлением соматической патологии. Однако, определенные сочетания симптомов поражения печени (синдромы) указывают на наследственную патологию. Поэтому крайне важно знать основные синдромы со стороны печени при конкретных наследственных заболеваниях, понимать этиопатогенез таких нарушений, грамотно проводить дифференциальную диагностику.
Ключевые слова
Для цитирования:
Ткачук Е.А., Семинский И.Ж. НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ, ПРОТЕКАЮЩИЕ С ПОРАЖЕНИЕМ ПЕЧЕНИ (ЛЕКЦИЯ). Байкальский медицинский журнал. 2024;3(1):78-95. https://doi.org/10.57256/2949-0715-2024-1-78-95
For citation:
Tkachuk E.A., Seminsky I.Zh. HEREDITARY DISEASES OCCURRING WITH LIVER DAMAGE (LECTURE). Baikal Medical Journal. 2024;3(1):78-95. (In Russ.) https://doi.org/10.57256/2949-0715-2024-1-78-95
Введение
Все наследственные заболевания печени можно разделить на моногенные и мультифакториальные [1]. Моногенные заболевания возникают при наличии патогенной мутации в одном из генов, отвечающих за определенное звено метаболизма. Мультифакториальные заболевания связаны с совместным влиянием нескольких патогенных вариантов мутаций разных генов и факторов окружающей среды [2].
Мультифакториальные заболевания, связаны с генами, которые, как правило, отвечают за метаболические процессы и имеют в своем составе нуклеотидные замены, так называемые полиморфизмы. Не все полиморфизмы могут приводить к патологии, как и мутации, они могут быть вредными, полезными и нейтральными для организма [3]. Наличие такого полиморфизма можно считать предрасположенностью к развитию определенного заболевания и это, как правило, точка зрения терапевта. С точки зрения генетики, которая учитывает пенетрантность и экспрессивность гена – это наследственное мультифакториальное заболевание с различной степенью проявления гена, а факторы внешней среды и образ жизни определяют с какой скоростью развивается заболевание и когда оно манифестирует. Тип наследования при многофакторных заболеваниях проследить можно, однако сделать это на практике бывает сложно из-за участия в патогенезе данной группы заболеваний сразу многих факторов (включая ненаследственные) и стертого характера проявлений [1, 2, 3].
Моногенные заболевания печени связаны с мутацией в одном из генов и подчиняются механизмам наследования известным в генетике, в этом случае можно проследить тип наследования. Однако, при изучении генеалогического анамнеза надо помнить, что любая мутация может наследоваться, а может появиться de novo [1, 2, 3].
Все наследственные заболевания печени (в т.ч. моногенные, на примере которых будет рассматриваться дифференциальная диагностика) проявляются различными синдромами, известными в гепатологии. К ним относятся: синдром холестаза, синдром желтухи, синдром печеночно-клеточной недостаточности, иммуно-воспалительный синдром (мезенхиально-воспалительный), синдром цитолиза, синдром портальной гипертензии, фульминантной печеночной недостаточности (ФПН), синдром нарушения белково-синтетической функции печени, синдром портальной гипертензии, отечно-асцитический синдром, синдром печеночной энцефалопатии, синдром острой и хронической печеночной недостаточности, гепаторенальный синдром, геморрагический синдром, астеноневротический синдром, синдром интоксикации, болевой синдром, диспептический синдром, синдром гиперэстрогенемии, гепатомегалия, гепатоспленомегалия, цирроз печени, жировой гепатоз. Именно с выделения синдромов начинается диагностика наследственных заболеваний печени, после того как врач убедиться, что заболевание носит именно наследственный характер [4].
В сравнении с другими орфанными заболеваниями, нозологические формы наследственных заболеваний печени не так и много, но они встречаются чаще, чем все остальные. Более частое поражение печени также связано с ее ведущей ролью в клинической картине наследственных болезней [5]. Так поражения печени происходит при: нарушениях цикла мочевины, обмена углеводов, обмена металлов, окисления жирных кислот, обмена аминокислот, митохондиальных болезнях, нарушениях синтеза жирных кислот, обмена гема и порфиринов, метаболизма холестерина, наследственных нарушениях гликозилирования, артериопечёночных дисплазиях (синдром Алажиля), дефектах секреции желчи (внутрипеченочный семейный холестаз), нарушениях обмена липидов. При этих заболевания поражения печени выходят на первый план, определяя тяжесть и исходы заболевания [1, 3, 5].
Можно также выделить группу наследственных заболеваний, при которых поражения печени имеют место, но являются второстепенными, потому что не определяют клинические исходы заболевания. К ним относятся лизосомные болезни накопления (болезнь Гоше, мукополисахаридозы, альфа-маннозидоз, болезнь Помпе) и пероксисомные болезни (синдром Цельвегера, болезнь Рефсума) [6].
Как видно из примеров приведенных заболеваний, клинические проявления наследственных поражений печени многообразны, поэтому для эффективной диагностики в клинической практике важно придерживаться синдромального подхода. Это позволяет на первом этапе диагностики очертить круг патологии, которую необходимо рассмотреть.
Группы наследственных заболеваний, протекающих с поражением печени
Среди наследственной патологии, при которой оказывается затронута печень выделяют самые разные группы заболеваний. Поэтому патогенетические механизмы печеночных проявлений могут быть самыми разнообразными, как и исходы заболеваний. В клинической диагностике важно определить характер и степень поражения печени, время манифестации заболевания и сопоставить с другими внепеченочными проявлениями (см. табл.1).
Таблица 1.
Группы наследственных заболеваний, протекающих с поражением печени
Группа заболеваний | Заболевания | Печеночные синдромы | Другие синдромы и клинические особенности |
Нарушения цикла мочевины | Цитруллинемия 1 типа, Дефицит Орнитинтранскарбамилазы, Дефицит аргининосукцинатлиазы, дефицит аргиназы 1 типа, Синдром гиперорнитинемии-гипераммониемии-гомоцитруллинурии, Синдром Рея | Гепатомегалия Цитолиз Нарушение белко-синтетической функции Печеночная Энцефалопатия Печеночная Недостаточность
| Гипераммониемия Респираторный алкалоз Угнетение сознания от сомноленции до комы, необычные и необъяснимые неврологические расстройства, эпизодический характер проявлений Подозрение на отравление Отказ/отвращение к мясной пище |
Нарушения обмена углеводов | Галактоземия, фруктоземия, гликогенозы (болезнь Помпе, болезнь Данон, болезнь Гирке, болезнь Андерсена, болезнь Таруи, болезнь Хага, болезнь Херса, болезнь Форбса-Корби), альфа-маннозидоз, мукополисахаридозы, GM-1 ганглиозидоз | Гепатомегалия | Гипогликемия Диспепсия (диарея, запоры, вздутие живота) Задержка в физическом развитии Задержка в психическом развитии Нарушение почек Повышенная уязвимость к инфекциям |
Нарушения обмена металлов | Болезнь Вильсона-Коновалова | Синдром желтухи Гепатомегалия Печеночная недостаточность | Неврологическая симптоматика: Тремор, атаксия, судороги Психические расстройства: депрессия, агрессия, беспокойство, раздражительность и эмоциональная лабильность Гематологические симптомы: тромбоцитопения, анемия Нарушения функции почек: повышенное выделение меди с мочой Остеопороз: Ухудшение костной ткани из-за меди, которая накапливается в костях. Кайзер-Флейшерово кольцо: Кольцо, образующееся в радужке глаза из-за отложения меди. Повышенное выделение меди с мочой |
Нарушения обмена аминокислот и органических кислот | Тирозинемия 1 типа, метилмалоновая ацидурия, лейциноз, глутаровая ацидемия типа II, изовалериановая ацидурия | Гепатомегалия Цирроз Печеночная недостаточность | Неврологические нарушения: задержка физического и психического развития, энцефалопатия, эпилепсия Астенический синдром Нарушения пищеварения: органические кислоты в моче, тошнота, рвота, запоры, поносы и т.д.) Нарушения пигментации кожи, волос и глаз Различные формы анемии Повышенная уязвимость к инфекциям |
Нарушения окисления жирных кислот | Дефицит среднецепочечной ацил-КоА дегидрогеназы (MCADD) Недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы (LCHAD) Дефицит очень длинноцепочечный ацил-СоА-дегидрогеназы (VLCADD) Глутаровая ацидемия типа II, Рейе-подобный синдром | Гепатомегалия Печеночная недостаточность (LCHAD) Жировой гепатоз Цирроз Фиброз | Гипогликемия (MCAD) Резкая слабость и усталость Повышенная уязвимость к инфекциям Кетоацидоз Кардиомиопатия Неврологические нарушения: судороги, задержка в психомоторном развитии, психические расстройства Нарушение функций почек Нарушение роста и развития |
Митохондиальные болезни | Синдром Альперса-Хуттенлохера (Синдром истощения митохондриальной ДНК 4А), DGUOK-синдром (Синдром истощения митохондриальной ДНК 3), Дефицит митохондриального комплекса I ядерный тип 20 | Острая печеночная недостаточность Синдром цитолиза Синдром холестаза Стеатоз Фиброз Цирроз (микро- и макронодулярный) | Неврологические нарушения: эпилепсия, параличи, сильная усталость, слабость и повышенная чувствительность к физической активности, нарушения координации и моторики Задержка развития и умственное отставание Нарушения зрения, слуха и речи Кардиомиопатия, аритмии Нарушение моторики желудочно-кишечного тракта, диспепсические расстройства (рвота, поносы, запоры) Изменение цвета и текстуры кожи, волос и глаз. Ослабление иммунитета и повышенная уязвимость для бактериальных, вирусных и грибковых инфекций |
Лизосомные болезни накопления (Мукополисахаридозы) | МПС I типа (синдром Гурлер (H), Шейе (S) и Гурлер — Шейе (H/S)) МПС II типа (синдром Хантера) МПС III типа (синдром Санфилиппо) МПС IV типа (синдром Моркио) МПС VI типа (синдром Марото — Лами) МПС VII типа (синдром Слая) и др. | Гепатомегалия Гепатоспленомегалия Фиброз Жировой гепатоз | Скелетные дисплазии Кардиомиопатия с кардиомегалией, митральный пролапс, недостаточность клапанов сердца Дыхательные нарушения Нарушения соединительной ткани Нарушения роста и развития Интеллектуальные нарушения |
Пероксисомные болезни | Синдром Цельвегера, неонатальная адренолейкодистрофия, болезнь Рефсума новорожденных и взрослых, недостаточность пероксисомной 3-оксоацил-Коа-тиолазы, ризомиелическая точечная остеохондродисплазия, Х-сцепленная адренолейкодистрофия, глутаровая ацидурия тип III, гипероксалурия тип I | Гепатоспленомегалия Желтуха
| Нейрологические нарушения: моторные и психомоторные задержки, общая гипотония мышц, появление патологических рефлексов, судорожный синдром, задержка психомоторного развития, психо-неврологические нарушения, косоглазие и слепота Метаболические изменения: появление кристаллов оксалата кальция, повышенный уровень желчных кислот. Поражение внутренних органов: почек, сердца, скелетных мышц, глаз, костей. Рост и развитие: задержка роста, деформации костей, появление множественных кистозных образований, задержка полового развития. Врожденные аномалии: дефекты развития скелета, лица и других органов. |
Нарушение обмена гема и порфиринов | Порфирия с дефицитом дегидратазы-АЛК (дельта-аминолевулиновой кислоты), острая перемежающаяся порфирия, наследственный гемохроматоз | Цирроз Гепатоспленомегалия | Боли в животе, запоры или диарея, тошнота, гипертензия, тахикардия, парез мочевого пузыря Неврологический дефицит, моторная полиневропатия, энцефалопатия, дыхательная недостаточность, тревога, депрессия, психоз. Фотодерматоз Рабдомиолиз и развитие острого интерстициального нефрита Слабость, быстрая утомляемость, признаки анемии, снижение аппетита, потеря веса, лихорадка |
Нарушения метаболизма холестерина | Семейная гиперхолестеринемия | Жировой гепатоз Фиброз Цирроз Печеночная недостаточность | Атеросклероз Цереброваскулярные заболевания Панкреатит Ксантомы |
Наследственные нарушения гликозилирования | Болезнь Жакена (PMM2-CDG, CDG-Ia, наследственный дефицит фосфоманномутазы 2), Синдром нарушения гликозилирования 1b типа | Гепатомегалия Жировой гепатоз Печеночная недостаточность Синдром желтухи | Задержка психомоторного развития Гипотония Интеллектуальная отсталость Эпилепсия Поражения сердца Нарушение слуха и зрения Костные дисплазии Снижение иммунной функции |
Артериопечёночные дисплазии | Синдром Алажиля
| Синдром холестаза (внутрепеченочный) Гепатомегалия Синдром цитолиза Синдром желтухи | Задержка психомоторного развития Умственная отсталость Нарушениями зрения, слуха Костные аномалии: остеопороз, остеомаляция, костные деформации, амилоидоз костей Нарушения нервной системы: мышечная слабость, онемения, нарушения чувствительности и координации движений, Увеличение белков крови, связанных с амилоидозом |
Дефекты секреции желчи | Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ): ПСВХ I типа (болезнь Байлера), ПСВХ II типа (синдром Байлера), ПСВХ III типа, Синдром Жильбера, Синдром Криглера-Найяра | Синдром холестаза (внепеченочный) Синдром желтухи Гепатоспленомегалия | Гиперпигментация кожи Анемия Неврологические нарушения: интеллектуальные отклонения, задержка психомоторного развития, судороги. Наличие кристаллических инклюзий в эритроцитах |
Нарушения обмена липидов | болезнь Гоше, болезнь Вольмана (ДЛКЛ), болезнь Нимана-Пика С (также А и B), НАЖБП, Абеталипопротеинемия (синдром Бассена-Корнцвейга), болезнь Фабри, G1- и G2-ганглиозидозы, болезнь Краббе, метахроматическая лейкодистрофия | Жировой гепатоз Гепатит Синдром желтухи Холестаз Цирроз Фиброз печени Снижение белково-синтетической функции печени
| Цереброваскулярные заболевания Атеросклероз Риск развития диабета Подагра Ксантомы вокруг глаз и на суставах. Повышенный риск развития рака |
Нарушение функции и/или структуры белков | Недостаточность альфа-1-антитрипсина (А1АТ) | Синдром холестаза Синдром желтухи Печеночная недостаточность Гепатомегалия Печеночная карцинома | Хронические обструктивные заболевания легких (эмфизема и др.) Эритема узелковидная Панкреатит Ревматологические проявления Соединительнотканная патология Повышенный риск сердечно-сосудистых заболеваний (атеросклероз, инфаркт миокарда и инсульт) |
Нарушения цикла мочевины. Это группа наследственных заболеваний, при которых в организме нарушается обмен или утилизация мочевины. Цикл мочевины еще называется орнитиновый цикл или цикл Кребса - Гензелейта. Он представляет собой цикл преобразования азотсодержащих компонентов (в основном белковых), а также пуринов и пиримидинов в орнитин и мочевину [7].
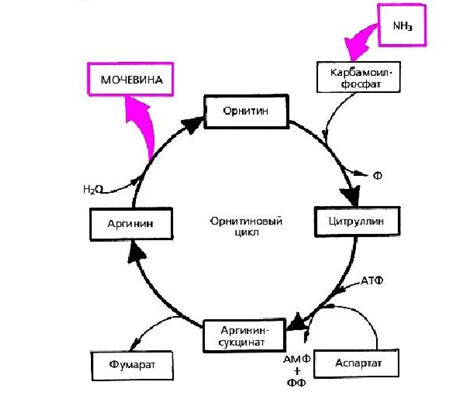
Рис. 1. Цикл образования мочевины
В основном цикл мочевины функционирует в печени (в митохондриях или цитозоле гепатоцита). В результате осуществления цикла мочевины происходит переработка самого токсичного вещества в организме - аммиака. Цикл мочевины позволяет преобразовать аммиак в мочевину, которая затем выделяется через почки с мочой [7].
Нарушения цикла мочевины (НЦМ) могут быть вызваны дефицитом ферментов, необходимых для нормального протекания этого процесса. В результате чего повышается уровень аммиака в крови (гипераммониемия - повышение уровня аммония (NH4+) в крови выше 100 мкМ/л у доношенных детей и более 150 мкМ/л у глубоко недоношенных новорожденных детей, более 50 мкМ/л у старших детей и взрослых), что приводит к разнообразным токсическим проявлениям, в том числе неврологическим нарушениям. Симптомы и тяжесть нарушений цикла мочевины могут различаться в зависимости от конкретного генетического дефекта. Некоторые общие симптомы могут включать задержку развития, повышенную раздражительность, энцефалопатию, рвоту, судороги и кому. И конечно происходит повреждение печени, которое проявляется в виде гепатомегалии, цитолиза, нарушения белко-синтетической функции печени, печеночной недостаточности[7].
НЦМ часто характеризуются манифестацией в раннем возрасте, кризами, и в отсутствии своевременного лечения могут заканчиваться летальным исходом в раннем детском возрасте. Как правило, они связаны с дефектом ферментов (нет фермента или уровень его снижен, или изменена его структура). Такие заболевания еще называют первичными гиперамммониемиями. Выделяют проксимальные первичные гипераммоиемии (в зависимости от локализации ферментного дефекта, т.е. до включения в орнитиновый цикл - дефекты генов CPS1, NAGS и OTC) и дистальные, протекающие в цитоплазме клеток печени (дефекты генов ASS, ASL, ARG, SLC25A15). Также выделяют дефекты трансмембранных транспортеров орнитина и цитруллина, вызывающих ННН-синдром (гипераммониемия, гиперорнитинемия, гомоцитруллинурия - дефект гена SLC25A15) и недостаточность цитрина (дефекты генов ORNT1, CTLN2) [8].
Позднее начало НЦМ развивается при незначительном снижении активности ферментов орнитинового цикла. Первые клинические признаки могут появляться в подростковом и взрослом возрасте, при этом гипераммониемия бывает менее выражена, а клинические проявления слабее, чем при неонатальных формах НМЦ. Основными клиническими симптомами являются рвота, снижение аппетита, вялость, головная боль и нарушения поведения, нарушения сна, бред, галлюцинации и психозы [7].
К наиболее часто встречающимся и опасным НЦМ относят цитруллинемию 1 типа (CTLN2), дефицит орнитинтранскарбамилазы (OTC), недостаточность аргининсукцинат синтетазы (ASSD), дефицит аргининосукцинатлиазы (ASL), дефицит аргиназы 1 типа (ARG), синдром гиперорнитинемии-гипераммониемии-гомоцитруллинурии (ННН-синдром (ORNT1)), синдром Рея [8].
Для НЦМ характерен аутосомно-рецессивный тип наследования. Исключение составляет дефицит орнитинтранскаромилазы (OTC), имеющий Х-сцепленное наследования. Суммарная частота НЦМ составляет в среднем 1:8000 живых новорожденных, однако несвоевременная диагностика, как правило, приводит к тяжелым последствиям [2, 7].
Цитруллинемия 1 типа - одно из самых тяжелых нарушений цикла мочевины, имеет аутосомно- рецессивный тип наследования, связана с мутацией в гене ASS1, кодирующем аргининосукцинатсинтетазу, которая участвует в цикле мочевины. Неонатальная форма цитруллинемии 1 типа протекает тяжело и остро, манифестирует, как правило, через 24-72 часа после рождения. Появляются срыгивания, отказ от еды, рвота, дыхательные расстройства (тахипноэ, апноэ и другие), признаки сепсиса и гипотермия, повышенная возбудимость или угнетение ЦНС, диффузная мышечная гипотония с гипертонусом в дистальных отделах конечностей, судорожный синдром, позднее развивается кома.
Следует помнить, что клинический фенотип поздних форм НЦМ во многом сходен [7].
Нарушения обмена углеводов. Наследственные нарушения обмена углеводов - это группа редких генетических заболеваний, связанных с нарушением метаболизма гликогена, либо других углеводов [9].
Гликогенозы обусловлены дефектами ферментов, которые участвуют в синтезе или расщеплении гликогена. В результате этих дефектов гликоген накапливается в тканях организма, в том числе в печени, что может привести к различным клиническим признакам. Общими симптомами гликогенозов могут быть гипогликемия, задержка физического развития, гепатомегалия, мышечная слабость, кардиомиопатия и другие проявления [9]. Известны такие гликогенозы как болезнь Помпе (GAA), болезнь Данон (LAMP2), болезнь Гирке (G6PC), болезнь Андерсена (KCNJ2), болезнь Таруи (PFKM), болезнь Хага (PHKA2), болезнь Херса (PYGM), болезнь Форбса-Корби (AGL). Практически все гликогенозы сопровождаются поражением печени, однако степень поражения может быть разной [8].
Мутация гена D-маннозидазы (MAN2B1) вызывает альфа-маннозидоз, при котором накопление в лизосомах маннозо-содержащих олигосахаридов приводит, в том числе к гепатомегалии [7, 9].
GM-1 ганглиозидоз (мутация гена лизосомной-галактозидазы (GLB1) вызывает наpушение распада в лизосомах кеpатансульфата и ганглиозида GМ1, который является важным компонентом мембpанных структур нейpонов. Увеличение количества кеpатансульфата в лизосомах печени и селезенке приводит к гепатоспленомегалии [9].
Галактоземия (дефект фермента галактозо-1-фосфат уридилтрансферазы, кодируемого геном GALT) сопровождается накоплением нерасщепленной галактозы в просвете кишечника, что оказывает токсический эффект на головной мозг, печень, почки и кишечник. Возникают срыгивания, диарея, плохая прибавка массы тела, появляются признаки поражения печени: гепатомегалия, гепатоспленомегалия, гипоальбуминемия, гипербилирубинемия, повышение уровня печеночных ферментов, нарушения свертываемости крови, асцит. Нередко галактоземия сопровождается гипогликемией. Сопутствующим всегда бывает синдром избыточного бактериального роста, который провоцирует остро развивающийся сепсис, вызванный E.coli [9].
При фруктоземии (дефект фермента альдолазы B, кодируемого геном ALDOB) возникает резкая нагрузка на печень из-за вынужденной метаболизации липидов и все это происходит в условиях дефицита энергии, что приводит к нарушению функции печени [9].
Нарушения обмена металлов. Среди всех наследственных нарушений обмена металлов серьезное поражение печени происходит при болезни Вильсона-Коновалова. При этом заболевании избыточное отложение меди в органах и тканях возникает из-за мутации гена ATP7B, который способствует встраиванию ионов меди в белок церулоплазмин. Так как церулоплазмин синтезируется печенью, то и нарушения его метаболизма оказывает значительное патологическое влияние на печень. Поэтому помимо разнообразной неврологической и психической симптоматики у больных развивается синдром желтухи, гепатомегалия, печеночная недостаточность. Это заболевание относится к числу трудно диагностируемых в связи с длительным латентным течением и разнообразной клинической симптоматикой, оно может манифестировать как в детском и подростковом, так и в старшем возрасте [10].
Нарушения обмена аминокислот (аминоацидопатии) и органических кислот (органические ацидурии). Аминоацидопатии и органические ацидурии вызваны образованием токсичных веществ в результате нарушенного обмена определенных кислот. Как правило, это либо сам субстрат обмена (который поступает с пищей), либо избыточный метаболит прямого или обходного пути. В случае, если эти вещества в большом объеме являются для организма токсичными, то в первую очередь повреждается печень, как основной орган детоксикации. Начало большинства заболеваний данной группы связано с грудным вскармливанием и поступлением белка. Однако, как показывает практика, некоторые нарушения обмена аминокислот и органические ацидурии могут долго компенсироваться организмом и клинически не проявляться. Основными внепеченочными нарушениями при этом являются неврологические синдромы [7].
Тирозинемия 1 типа (НТ1) - наследственное аутосомно-рецессивное заболевание, обусловленное мутациями в гене FAH, кодирующего фермент фумарилацетогидролазу. Данный фермент осуществляет конечный этап деградации тирозина на нетоксичные фумарат и ацетоацетат. В результате мутации в гене FAH распад тирозина осуществляется по альтернативному пути с образованием высокотоксичных и канцерогенных сукцинилацетона, малеилацетоацетата, фумарилацетоацетата. Накопление этих токсических продуктов тормозит окислительное фосфорилирование и блокируют цикл Кребса, что приводит к прогрессирующей патологии печени с развитием печеночной недостаточности, цирроза. Кроме этого развиваются тубулопатии с формированием ренальной тубулопатии, гипофосфатемического рахита, синдрома Фанкони [7].
Метилмалоновая ацидемия (MMA) – наследственное заболевание, связанное с нарушением обмена метилмалоновой кислоты (ген MUT) и кобаламина (витамина В12) (ген MCEE) на уровне перехода метилмалонилКоА в сукцинил-КоА, сопровождающееся нарушением метаболизма ряда аминокислот (изолейцин, валин, треонин, метионин), жирных кислот с нечетным числом атомов углерода и холестерина [7].
Другие заболеваний из этой группы (лейциноз, глутаровая ацидемия типа II, изовалериановая ацидурия) также связаны с нарушениями отдельных ферментов и имеют тяжелое течение, в основном манифестирующее в раннем возрасте [7].
Нарушения окисления жирных кислот. Наследственные нарушения митохондриального β-окисления жирных кислот (FAOD) – группа моногенных заболеваний, связанных с нарушением митохондриального β-окисления жирных кислот и транспорта их карнитином в митохондрии. Эта группа заболеваний всегда протекает с нарушением энергетического обмена, а также сопровождается метаболическим ацидозом, гипогликемией, гипераммониемией и поражением внутренних органов, в том числе печени, как органа, который продуцирует кетоновые тела. Как известно, жирные кислоты (ЖК) являются важным источником энергии. Особое значение жирные кислоты имеют для скелетных мышц, сердца и печени, так как обеспечивают их энергией в условиях голодания. Жирные кислоты мобилизуются из жировой ткани и транспортируются в кровоток в связанном с альбумином состоянии [11].
Большинство тканей способно расщеплять ЖК до углекислого газа и воды. На поздних стадиях голодания они становятся преимущественным источником продукции энергии через их окисление в скелетных мышцах и использование для синтеза кетоновых тел в печени. ЖК являются главным источником энергии для сердца: в норме 60-70% энергии, необходимой для сердечной мышцы, обеспечивается окислением ЖК, и выше 70% при голодании и диабете [7, 11].
Для многих форм FAOD характерно поражение мышечной ткани с развитием миопатии и/или кардиомиопатии, что связано как с истощением энергетических ресурсов, так и с токсическим действием субстратов блокированных ферментных реакций на мышечную ткань [7,11].
Выделяют следующие важные наследственные нарушения окисления жирных кислот: дефицит среднецепочечной ацил-КоА дегидрогеназы (MCADD, отвечает ген ACADM), недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы (LCHAD, отвечает ген HADHA), дефицит очень длинноцепочечной ацил-СоА-дегидрогеназы (VLCADD, отвечает ген ACADVL), глутаровая ацидемия типа II, Рейе-подобный синдром. Клиника этих заболеваний сходна и характеризуется полиморфизмом проявлений, связанных с энергетической недостаточностью [12].
Митохондриальные болезни. Эта группа заболеваний всегда протекает с нарушением энергетического обмена и затрагивает ткани, которые наиболее чувствительны к недостатку энергии (табл. 2). Печень как раз относится к органам с большим энергопотреблением, однако не все митохондриальные болезни протекают с выраженным поражением печени. Чаще поражения печени отмечаются при младенческих и детских энцефалогепатопатиях [13].
Таблица 2
Основные клинические симптомы митохондриальных заболеваний (МЗ) [2]
Система органов | Симптомы | Примеры МЗ |
Нервная и мышечная | Задержка психомоторного развития. Синдромом «вялого ребенка». Мышечная гипотония, мышечная слабость (проксимальные >дистальные и верхние >нижние конечности). Периферическая невропатия. Атаксия. Дизартрия. Птоз. Офтальмоплегия. Бульбарные нарушения. Пирамидные нарушения. Инсультоподобные эпизоды. Мигрень. Тремор, хорея. Дистония. Судороги. Миоклонии. Лейкоэнцефалопатия (по данным МРТ) | Большинство митохондриальных заболеваний |
Сердечно-сосудистая | Гипертрофическая кардиомиопатия, фибрилляция предсердий, атриовентрикулярная блокада, синдромом Вольфа-Паркинсона- Уайта, блокада проведения по пучку Гиса | Синдромы KSS, MERRF и MELAS, синдром Сенгерса, синдром Барта |
Пищеварительная | Острая печеночная недостаточность, синдром цитолиза, синдром холестаза, стеатоз, фиброз, микро- и макронодулярный цирроз. Нарушение моторики желудочно-кишечного тракта | Младенческие и детские энцефалогепатопатии |
Выделительная | Острая или хроническая почечная недостаточность, нефролитиаз, нефротический синдром, почечные кисты, почечный канальцевый ацидоз, Барттер-подобный синдром, синдром де Тони-Дебре-Фанкони (фосфатурия, глюкозурия, аминоацидурия), очаговый сегментарный гломерулосклероз, тубулоинтерстициальный нефрит, нефрокальциноз | Дефекты генов, кодирующих комплекс дыхательной цепи |
Эндокринная | Сахарный диабет первого типа. Недостаточность гормона роста, гипотиреоз, гипопаратиреоз, гипогонадотропный гипогонадизм | Синдромы KSS, Пирсона, MELAS |
Кроветворная | Сидеробластная анемия в сочетании с нейтропенией и/или панцитопенией | Синдром Пирсона. М3 с выраженным лактат-ацидозом |
Орган зрения и орган слуха | Атрофия зрительного нерва. Пигментная дегенерация сетчатки. Нейросенсорная тугоухость | Синдромы Ли, KSS, LHON, РЕО, NARP, MERRF, MELAS, синдромы истощения мтДНК |
Митохондриальные болезни - одна из самых сложных групп в диагностике. Эти сложности связаны с наличием ядерного и митохондриального типов наследования, явлениями гетероплазмии и широким спектром клинических проявлений (от латентных вариантов до тяжелых клинических форм). Наиболее известные митохондриальные заболевания, при которых имеет место поражение печени: синдром Альперса-Хуттенлохера (синдром истощения митохондриальной ДНК 4А), DGUOK-синдром (синдром истощения митохондриальной ДНК 3), дефицит митохондриального комплекса I ядерный тип 20 [13].
Лизосомные болезни накопления (ЛБН) - патология лизосом, при которой из-за дефекта фермента, вещества в норме метаболизирующиеся в лизосомах не могут расщепиться и накапливаются в лизосомах. Накопление происходит во всех органах и тканях, в том числе и в печени. Поэтому практически все лизосомные болезни накопления протекают с поражением печени в основном по типу гепатомегалии и гепатоспленомегалии. Насчитывается около 70 нозологических форм лизосомных болезней [14]. В основном ЛБН с поражением печени представлены муколисахаридозами. Однако некоторые авторы указывают, что поражения печени может иметь место и при гликопротеинозах (аспартилглюкозаминурия, сиалидоз, фукозидоз, болезнь Шиндлера, галактосиалидоз), муколипидозах (муколипидоз 2, 3С, 4), нейрональных цероидных липофусцинозах (младенческая форма (НЦЛ 1 типа), подростковая форма (НЦЛ 2 типа), юношеская форма (НЦЛ 3 типа), других НЦЛ 5,6,7,8,10 типа) и других ЛБН (цистиноз, болезнь Салла, множественная сульфатная недостаточность) [15].
Мукополисахаридозы (МПС) - один из видов лизосомных болезней накопления. По своей структуре мукополисахариды это углеводно-белковые комплексы. Мукополисахариды являются важной составной частью костей, хрящей, сухожилий, роговицы, кожи и соединительной ткани. Поэтому основными нарушениями при мукополисахаридозах будут изменения в этих органах. Накапливаясь в лизосомах клеток органов и тканей, мукополисахариды нарушают развитие костной, хрящевой и соединительной ткани, вызывая дизостозы, грыжи, кардиомиопатию, нарушают развитие нервной системы, вызывая интеллектуальные расстройства, нарушают функцию печени, вызывая фиброз и ее увеличение. Часто именно нарушения со стороны печени обращают на себя внимание, несмотря на имеющиеся более яркие фенотипические проявления мукополисахаридозов. Выделяют около 11 типов мукополисахаридозов, однако более распространены МПС I типа (синдром Гурлер (H), Шейе (S) и Гурлер-Шейе (H/S)), МПС II типа (синдром Хантера), МПС III типа (синдром Санфилиппо), МПС IV типа (синдром Моркио), МПС VI типа (синдром Марото-Лами), МПС VII типа (синдром Слая) и др. [16].
Пероксисомные болезни - группа заболеваний пероксисом. Этот вид внутриклеточных органелл отвечает за метаболизм активных форм кислорода и азота, плазмалогенов, синтез фактора активации тромбоцитов, N-ацилглицинов, N-ацилтауринов, докозагексоеноевой, фитановой и пристановой жирных кислот, простаноидов и другие функции. Пероксисомы осуществляют функцию нейтрализации токсичных продуктов метаболизма и экотоксикантов, в том числе и этанола. Недостаточность функции пероксисом может приводить к тяжелым нейродегенеративным заболеваниям, нарушениям развития и дизморфиям, а также поражениям печени. Механизм поражения печени при пероксисомных болезнях связан с большим количеством пероксисом, в гепатоцитах, процессами β-окисления жирных кислот, за счет которой печень осуществляет синтез желчных кислот [17, 18]. На последних этапах желчные кислоты конъюгируются с таурином или глицином при помощи пероксисомальной ацил-СоА и уже в этой форме поступают в цитоплазму. Поэтому пероксисомы играют важную роль в метаболизме и гомеостазе холестерола в организме [19]. В связи с этим поражение печени при пероксисомных заболеваниях приводит к гепатоспленомегалии и желтухе.
К пероксисомным заболеваниям относят синдром Цельвегера (PEX1), недостаточность пероксисомной 3-оксоацил-КоА тиолазы (гены RTG1, RTG2), неонатальную адренолейкодистрофию (PEX), болезнь Рефсума (PHYH), ризомиелическую точечную остеохондродисплазию (EBP), Х-сцепленную адренолейкодистрофию (ABCD1), гипероксалурию тип I (AGXT) [8].
Нарушение обмена гема и порфиринов. Порфирии – это группа заболеваний связанных с нарушением синтеза гема. Синтез гема проходит в 8 этапов, за каждый из которых отвечает конкретный фермент, кодируемый определенным геном. Соответственно, для каждой формы порфирии существует специфичный ферментативный дефект (рис. 2) [20].
Наиболее активно процесс синтеза гема идет в печени и костном мозге. В печени гем включается в состав белков, участвующих в клеточном дыхании, расщеплении токсичных свободных радикалов и детоксикации ксенобиотиков. В костном мозге гем необходим для синтеза гемоглобина. Снижение активности ферментов становится причиной торможения синтеза гема, что ведет к накоплению его токсичных промежуточных метаболитов и поражению печени [20].
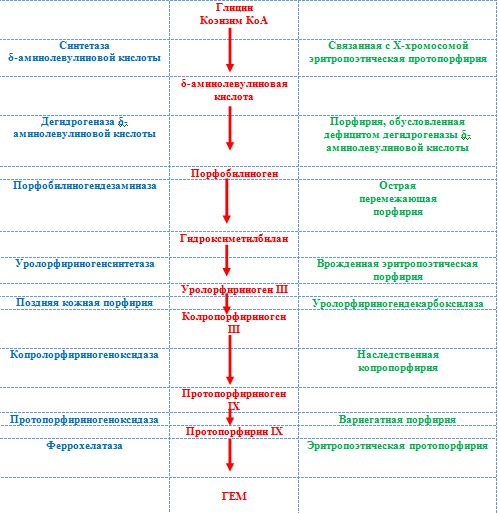
Рис. 2. Обмен порфиринов и порфирии
К нарушениям обмена гема и порфиринов можно отнести порфирию с дефицитом дегидратазы-АЛК (дельта-аминолевулиновой кислоты) (ген ALAD), острую перемежающуюся порфирию, наследственный гемохроматоз (HFE) [8].
Нарушения метаболизма холестерина. Наиболее часто встречается семейная гиперхолестеринемия. Это моногенное заболевание с аутосомно-доминантным типом наследования, сопровождается значительным повышением уровня холестерина липопротеидов низкой плотности в крови и преждевременным развитием и прогрессирующим течением атеросклероза. Самая частая причина семейной гиперхолестеринемии – это мутация в гене рецептора липопротеидов низкой плотности (LDLR). Рецептор расположен на поверхности гепатоцитов, участвует в связывании и выведении из кровотока циркулирующих липопротеидов низкой плотности (ЛПНП) [21]. Известно более 1600 мутаций гена LDLR. Еще одна возможная причина – мутация в гене аполипопротеина В (APOB), который кодирует апобелок В100 (апоВ), входящий в состав ЛПНП и ответственный за их связывание с рецептором. Мутация гена PCSK9 является еще одной причиной семейной гиперхолистеринемии. Ген PCSK9, кодирует пропротеинконвертазу субтилизин/кексин тип 9 - сериновую протеазу. Его мутация приводит к разрушению рецептора ЛПНП. Мутации, приводящие к усилению функциональной активности PCSK9 (миссенс-мутации), могут вызывать повышенние разрушения ЛПНП-рецепторов, в результате чего уменьшается количество рецепторов на поверхности клетки и развивается гиперхолестеринемия. Мутации в генах LDLRAP1, ABCG5, ABCG8, CYP7A1 наследуются рецессивно и клинически проявляются только у гомозигот по семейной гиперхолестеринемии. В последнее время в качестве генов-кандидатов семейной гиперхолестеринемии рассматриваются мутации в генах STAP1, LIPA и PNPLA5 [8].
Хотя семейная гиперхолестеринемия не является непосредственной причиной поражения печени, высокое содержание холестерина в крови может привести к формированию жировых отложений в печени и жировому гепатозу [21].
Наследственные нарушения гликозилирования. Гликозилирование - это посттрансляционная модификация белков, при которой молекулы глюкозы присоединяются к белкам. Этот процесс играет важную роль в регуляции стабильности белков, их транспорте и взаимодействии с другими молекулами [22].
Одним из основных механизмов поражениями печени при нарушениях гликозилирования является накопление промежуточных продуктов гликолиза и других метаболитов в гепатоцитах. Это может привести к дисфункции митохондрий, повреждению клеточных мембран и активации воспалительных процессов в органе.
Кроме того, гликозилирование играет важную роль в обмене липидов и участвует в формировании и секреции липопротеинов печенью. Нарушение этих процессов также может привести к жировому гепатозу, воспалительным явлениям в печени [22].
К нарушениям гликозилирования относятся болезнь Жакена (PMM2-CDG, CDG-Ia, наследственный дефицит фосфоманномутазы 2) (ген PMM2) и синдром нарушения гликозилирования 1b типа (MPI) [8].
Артериопечёночные дисплазии. Самым характерным заболеванием в этой группе является синдром Алажиля (ALGS или СА). Синдром Алажиля, также известный как гепатолентикулярная дегенерация, является редким наследственным заболеванием печени. Патогенез печеночных нарушений при синдроме Алажиля обусловлен мутациями в гене JAG1 (в хромосоме 20p12.2) и в гене NOTCH2 (в хромосоме 1p12). NOTCH2 кодирует трансмембранный белок, а JAG1 - его рецептор. Мутации в этих генах вызывают нарушения развития желчных протоков. В результате желчные протоки печени формируются суженными и деформированными. Желчь не может проходить через деформированные протоки и накапливается в печени, вызывая холестаз, гепатомегалию, цитолиз и желтуху. Внепеченочные проявления включают врожденный порок сердца, дефекты костей, аномалии глазного яблока и особые черты лица. Летальные случаи при СА, как правило, связаны с поражением легочной артерии и ее ветвей (чаще стеноз) и клапанов, тетрадой Фалло, дефектом межжелудочковой и межпредсердной перегородки, стенозом аорты и ее коарктацией, аневризмами головного мозга, артериопатией, долихоэктазией. При СА распространены костные аномалии, такие как выпуклый лоб, слияние позвонков, бабочковидные позвонки, полупозвонки, межреберные соединения, брахидактилия, умеренный гипертелоризм с глубоко посаженными глазами, седловидный или прямой нос с уплощенно-выпуклым кончиком и большие уши. СА проявляется также хроническим истощением, задержкой роста, умеренной умственной отсталостью. Больные предъявляют жалобы на сильный зуд, сухость, стянутость кожи [23].
Дефекты секреции желчи. К данной группе заболеваний относятся прогрессирующий семейный внутрипеченочный холестаз (ПСВХ): ПСВХ I типа (болезнь Байлера) (ген ATP8B1), ПСВХ II типа (синдром Байлера) (ATP8B1), ПСВХ III типа (ABCB4), синдром Жильбера (UGT1A1), синдром Криглера-Найяра (UGT1A1) [8].
Патогенез поражения печени при данной группе заболеваний сводится к холестазу, что приводит к желтухе, образованию камней в желчных протоках, боли и воспалению печени. В конечном итоге может развиться холангиолитиаз и желчный цирроз. Этиологическим фактором является мутация в гене UGT1A1. Ген UGT1A1 кодирует фермент уридиндифосфат-глюкуронилтрансферазу (УДФГТ). Этот фермент функционирует в гепатоцитах, преобразуя билирубин. Мутация в гене UGT1A1 вызывает ряд синдромов, выраженность которых зависит от активности фермента (синдром Криглера-Найяра I типа (синдром К-Н I), синдром Криглера-Найяра II типа (синдром К-Н II) и синдром Жильбера (CЖ). Синдром К-Н I характеризуется практически полным отсутствием УДФГТ в гепатоцитах (частота 0,6-1 случай на 1 млн.). Содержание непрямого билирубина может достигать 800-850 мкмоль/л, при этом отмечается злокачественное прогрессирующее течение с летальным исходом в раннем возрасте (при отсутствии трансплантации печени). При синдроме К-Н II активность УДФГТ составляет менее 20-30% от нормальной. Непрямой билирубин может повышаться до 300-350 мкмоль/л. Пациенты живут при естественном течении заболевания до 45-50 лет. СЖ отличается благоприятным течением. Частота распространения СЖ в мире среди взрослого населения вариабельна: в европейской популяции частота СЖ составляет 5-10%, среди амбулаторных пациентов в г. Москве - 24% [7]. При СЖ уровень непрямого билирубина чаще всего не превышает 85-90 мкмоль/л, что вызвано нерезким снижением активности УДФГТ. Продолжительность жизни пациентов с СЖ такая же, как у здоровых людей [24].
Развитие болезни Байлера обусловлено мутацией гена ATP8B1, расположенного в 18 хромосоме (локус 18q21-22). Этот ген отвечает за синтез АТФазы P-типа, которая поддерживает липидный баланс путем перемещения фосфолипидов. Данный фермент располагается на поверхности гепатоцитов. Его основная функция заключается в регулировании транспорта урсодезоксихолевой и хенодезоксихолевой кислот из печеночных клеток в желчные протоки. Тип наследственной передачи патологии - аутосомно-рецессивный [25]. В результате генетической мутации активность энзима P -типа АТФазы резко снижается, нарушается транспорт желчных кислот в протоки, желчные кислоты задерживаются в гепатоцитах, возникает внутрипеченочный холестаз [24, 25]. Это приводит к гибели печеночных клеток, разрастанию соединительной ткани, желтухе, гепатопоспленомегалии, циррозу печени [25].
Нарушения обмена липидов
Это группа заболеваний, которая характеризуется наследственными дефектами метаболизма жиров. При этом механизмы печеночных нарушений могут быть разными, но в итоге липиды накапливаются в организме, в том числе в клетках печени, повреждая последние [26].
Болезнь Гоше вызывается мутацией гена GBA и сопровождается снижением каталитической активности глюкоцереброзидазы, функция которой заключается в деградации гликосфинголипидов (или глюкоцереброзидов, глюкозилцерамидов) до глюкозы и церамидов. Дефицит фермента приводит к накоплению в лизосомах макрофагов неутилизированных липидов и образованию характерных клеток накопления (клеток Гоше). Следствием данного метаболического дефекта являются: хроническая активация макрофагальной системы, аутокринная стимуляция моноцитопоэза и увеличение абсолютного количества макрофагов, нарушение регуляторных функций макрофагов. В результате накопления макрофагов регистрируется спленомегалия (95%), гепатомегалия (87%), костные изменения (81%), хронические боли в костях (27%) и костные кризы (9%), тромбоцитопения (50%) и анемия (40%), задержка роста (34%). Болезнь Гоше наследуется аутосомно-рецессивно и встречается с частотой 1:40000 – 1:70000 (у евреев-ашкенази достигает 1:450 – 1:1000) [26].
Дефицит лизосомной кислой липазы (ДЛКЛ) – хроническое прогрессирующее заболевание, в основе которого лежит дефект гена LIPA, кодирующего лизосомную кислую липазу (ЛКЛ), что приводит к накоплению сложных эфиров холестерина и триглицеридов в печени, а также в селезенке, в стенках кровеносных сосудов и других органах и тканях. В результате этого развивается слабость, гепатомегалия или/и гепатоспленомегалия, задержка физического развития, повышение утомляемости, диарея, боли в животе, стеаторея, желтушный синдром, асцит, варикозное расширение вен пищевода (при развитии цирроза). Частота ДЛКЛ составляет 1:40000 – 1:300000 [26].
Болезнь Ниманна-Пика, типа С (НП-С) - наследственное мультисистемное заболевание. Причиной заболевания являются мутации в генах NPC1 (в 95% случаев) или NPC2 (около 4% случаев), что приводит к нарушению внутриклеточного транспорта липидов и накоплению холестерина и гликосфинголипидов в печени, головном мозге, селезёнке, лёгких, костном мозге и других тканях. Со стороны нервной системы при НП-С наблюдаются глазодвигательные расстройства в виде нарушений саккадических движений глаз (СДГ) или вертикального надъядерного паралича взора (ВНПВ), мозжечковые нарушения (атаксия, дисметрия), дистония, дизартрия, дисфагия и геластическая катаплексия, эпилептические судорожные приступы. Наследуется аутосомно-рецессивно. Частота распространения заболевания в среднем составляет 0,66-0,83 на 100000 живых новорожденных [26].
Неалкогольная жировая болезнь печени (НАЖБП) является одним из самых распространенных хронических заболеваний печени в мире и относится к наследственным мультифакториальным заболеваниям. Считается, что распространенность НАЖБП в странах Запада составляет 20-30%, а в Азии – 5-18%. [27].
Причинами НАЖБП являются мутация гена PNPLA3, а также мутация гена TM6SF2. Ген PNPLA3 кодирует адипонутрин, который по сути является фосфолипазой А, а мутация в этом гене (I148M) вызывает нарушение метаболизма триглицеридов. Носители аллели I148M гена PNPLA3 имеют более высокое содержание жира в печени и повышенный риск развития стеатогепатита, фиброза и цирроза печени. Полиморфизм гена TM6SF2 (rs58542926) вызывает нарушения функции белка, отвечающего за метаболизм стерола. НАЖБП является мультифакториальным заболеванием и за ее развитие отвечают и другие гены, определяющие инсулинорезистентность и метаболический синдром, поэтому клиническая картина НАЖБП отличается большим полиморфизмом проявлений. В итоге происходит отложение липидов в гепатоцитах и жировой гепатоз [27].
Абеталипопротеинемия (синдром Бассена-Корнцвейга) вызывается мутациями в гене МТТР, который индуцирует создание белка-переносчика микросомальных триглицеридов. Этот белок необходим для создания молекул, называемых β-липопротеинами в печени и кишечнике [28].
Благодаря β-липопротеинам осуществляется транспорт жиров, холестерина и жирорастворимых витаминов из кишечника в кровоток, поэтому эти питательные вещества могут усваиваться тканями всего организма. Достаточный уровень жиров, холестерина и витаминов необходим для нормального роста, развития и поддержания клеток и тканей [28].
Большинство мутаций гена МТТР приводят к продукции микросомального белка - переносчика триглицеридов с пониженной функцией или отсутствием функции, неспособным участвовать в образовании β-липопротеинов. Недостаток β-липопротеинов вызывает серьезное снижение всасывания (мальабсорбция) пищевых жиров и жирорастворимых витаминов из пищеварительного тракта в кровоток [28].
Нарушение функции и/или структуры белков, приводящее к патологии печени
Недостаточность альфа-1-антитрипсина (А1АТ), как правило, сочетается с поражением печени. Это заболевание вызывает мутация в гене SERPINA1 (наиболее распространенные варианты мутаций S (p.Glu288Val) и Z (р.Glu366Lys)), что приводит к снижению альфа-1-антитрипсина в крови. А1АТ является главным ингибитором сериновых протеаз в плазме человека. Его дефицит приводит к ускоренному разрушению паренхимы легких, приводящему к эмфиземе. Часть патологического А1АТ блокируется в гепатоцитах из-за неправильной упаковки и полимеризации. Накопление полимеризованного белка в эндоплазматической сети гепатоцитов приводит к хроническим заболеваниям печени: циррозу и злокачественным новообразованиям. Недостаточность А1АТ зачастую ошибочно диагностируется как ХОБЛ, бронхиальная астма или криптогенное заболевание печени. Наследуется по аутосомно-рецессивному или кодоминантному типу. Заболеваемость среди жителей Европы составляет 1:1500–5000 человек. Поражение печени чаще выявляется в раннем детском возрасте (до 4-х месяцев). Для взрослых более характерна легочная форма, которая может проявляться частыми бронхитами, пневмониями, развитием бронхообструктивного синдрома, эмфиземы и /или бронхоэктазов. Значимым фактором является курение: у курящих пациентов эмфизема легких развивается гораздо раньше [29].
Печеночные синдромы и соответствующие им заболевания
При диагностике наследственных заболеваний с поражением печени, важно помнить какие заболевания протекают с тем или иным печеночным синдромом. Например, синдром гепатомегалии является ведущим при следующих заболеваниях: гликогенозы (болезнь Помпе, болезнь Гирке), нарушения окисления жирных кислот, нарушения цикла мочевины, болезнь Вильсона-Коновалова, нарушения обмена аминокислот (тирозинемия 1 типа), мукополисахаридозы, наследственные нарушения гликозилирования, синдром Алажиля, недостаточность альфа-1-антитрипсина. Гепатомегалия при данных синдромах имеет разные механизмы формирования и быть более или менее выражена. Так наибольшую степень выраженности гепатомегалия достигает при гликогенозах и нарушении окисления жирных кислот.
Гепатоспленомегалия характерна для мукополисахаридозов, пероксисомных болезней и порфирии.
Холестаз характерен для синдрома Алажиля, дефектах секреции желчи (Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ): ПСВХ I типа (болезнь Байлера), ПСВХ II типа (синдром Байлера), ПСВХ III типа, Синдром Жильбера, синдроме Криглера-Найяра), недостаточности альфа-1-антитрипсина, митохондриальных заболеваниях (выражен слабо),
Жировой гепатоз может развиваться при нарушениях окисления жирных кислот, митохондиальных болезнях, мукополисахаридозах, нарушениях метаболизма холестерина, наследственных нарушениях гликозилирования, нарушениях обмена липидов.
Желтушный синдром характерен для нарушения обмена металлов, наследственных нарушений гликозилирования, синдрома Алажиля, дефектов секреции желчи, нарушении обмена липидов, недостаточности альфа-1-антитрипсина.
Синдром печеночной недостаточности часто развивается при нарушениях цикла мочевины, обмена аминокислот и металлов, митохондриальных заболеваниях, нарушениях обмена холестерина и гликозирования, нарушениях обмена липидов и функции белков.
Синдром нарушения белково-синтетической функции встречается при нарушениях обмена цикла мочевины и обмена липидов.
Синдром цитолиза чаще всего наблюдается при нарушениях обмена цикла мочевины.
Цирроз может быть финалом заболеваний, связанных с нарушением обмена аминокислот и органическими ацидуриями, нарушением окисления жирных кислот и липидов, митохондриальных болезней, нарушений обмена гема и холестерина.
Фиброз развивается чаще всего при нарушении обмена липидов и холестерина, лизосомных болезнях накопления, митохондриальных заболеваниях, нарушении окисления жирных кислот.
Выделяют сочетания синдромов и других проявлений, имеющие важное диагностическое значение (табл. 3).
Таблица 3
Диагностическое значение сочетания синдромов поражения печени с другими нарушениями
Сочетание синдромов | Заболевания/группы заболеваний |
Гепатомегалия + гипогликемия | Гликогенозы Нарушения окисления жирных кислот |
Поражения печени + неврологические нарушения | Митохондриальные гепатопатии Лизосомные болезни накопления Пероксисомные болезни Врожденные нарушения гликозилирования Болезнь Вильсона-Коновалова |
Поражение печени + пневмоторакс | Дефицит альфа -1 антитрипсина |
Острое начало + прогрессирующая фульмитантная печеночная недостаточность | Галактоземия тип 1 Нарушение цикла мочевины Митохондриальные гепатопатии Тирозимнемия 1 типа Болезнь Вильсона-Коновалова Болезнь Вольмана (ДЛКЛ) |
Поражение печени + синдром избыточного бактериального роста | Галактоземия |
Поражение печени + гипераммониемия | Нарушения цикла мочевины |
Поражение печени + кольцо Кайзера–Флейшера | Болезнь Вильсона-Коновалова |
Заключение. Заболевания печени в практике врача встречаются часто. Большинство из них не являются наследственными, но для дифференциальной диагностики врачам всех специальностей важно знать группы наследственных болезней, при которых имеются печеночные синдромы.
К сожалению, не всегда нарушения со стороны печени распознаются как наследственная патология и поэтому необходимо применять методы современной генетики для диагностики [30]. Некоторые пациенты могут долгое время наблюдаться у гастроэнтеролога, терапевта или педиатра, но не иметь реального диагноза, и соответственно не получать должного лечения. В связи с этим знание врачами всех специальностей форм наследственной патологии, при которых имеются поражения печени – важная задача медицинского образования.
Список литературы
1. Бочков Н.П., Пузырев В.П., Смирнихина С.А Клиническая генетика: учебник / под ред. Н. П. Бочкова, В.П. Пузырева, С.А. Смирнихина. М.: ГЭОТАР-Медиа: 2022. 592 с. [Bochkov N.P., Puzyrev V.P., Smirnikhina S.A. Clinical genetics: textbook / ed. N.P. Bochkova, V.P. Puzyreva, S.A. Smirnikhina. Moscow: GEOTAR-Media: 2022. 592 p. (In Russian)]
2. Гинтер Е.К., Пузырев В.П., Куцев С.И. Медицинская генетика: национальное руководство/под ред. Е.К. Гинтер, В.П. Пузырев, С.И. Куцев. Москва: ГОЭТАР-Медиа: 2022. 896 с. [Ginter E.K., Puzyrev V.P., Kutsev S.I. Medical genetics: national guidelines / ed. E.K. Ginter, V.P. Puzyrev, S.I. Kutsev. Moscow: GOETAR-Media: 2022. 896 p. (In Russian)] DOI: 10.33029/9704-6307-9-GEN-2022-1-896
3. Мутовин Г.Р. Клиническая генетика. Геномика и протеомика наследственной патологии: учебное пособие. М.: ГЭОТАР-Медиа: 2010. 832 с. [Mutovin G.R. Clinical genetics. Genomics and proteomics of hereditary pathology: a textbook. Moscow: GEOTAR-Media: 2010. 832 p. (In Russian)]
4. Бородулин В.И., Тополянский А.В. Клинические синдромы и симптомы. Эпонимический справочник практикующего врача. Миа: 2017. 580 с. [Borodulin V.I., Topolyansky A.V. Clinical syndromes and symptoms. Eponymous reference book for a practicing physician. Mia: 2017. 580 p. (In Russian)]
5. Строкова Т.В. Наследственные метаболические болезни печени. Актуальные проблемы проблемы детской гастроэнтерологии. Спецвыпуск «Школа для практикующих врачей» 60-65. [Strokova T.V. Hereditary metabolic liver diseases. Current problems in pediatric gastroenterology. Special issue “School for practicing doctors” 60-65 (In Russian)] URL: https://umedp.ru/upload/iblock/883/selection_3.pdf
6. Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease metaanalytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. https://doi.org/10.1002/hep.28431
7. Краснопольская К.Д. Наследственные болезни обмена веществ. Справочное пособие для врачей. - М., 2005, 364 с. [Krasnopolskaya K.D. Hereditary metabolic diseases. Reference manual for doctors. - M., 2005, 364 p. (In Russian)]
8. Online Mendelian Inheritance in Man. McKusick-Nathans Institute of Genetic Medicine, Johns Hopkins University School of Medicine, 2023. https://www.omim.org/help/copyright
9. Литвицкий П. Ф., Мальцева Л. Д. Расстройства углеводного обмена у детей: гипогликемия, гипергликемия, гликогеноз, агликогеноз, гексоземия. Вопросы современной педиатрии. 2017; 16 (5): 362–369. [Litvitsky P. F., Maltseva L. D. Disorders of carbohydrate metabolism in children: hypoglycemia, hyperglycemia, glycogenosis, aglycogenosis, hexosemia. Issues of modern pediatrics. 2017; 16 (5): 362–369 (In Russian)] doi: 10.15690/vsp.v16i5.1800)
10. Самодова О.В., Смирнова Г.П., Кригер Е.А. Болезнь Вильсона – Коновалова в практике педиатра: клинические наблюдения с разными вариантами течения и исхода. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2023;33(1):77-83. [Samodova O.V., Smirnova G.P., Krieger E.A. Wilson–Konovalov disease in pediatric practice: clinical observations with different variants of course and outcome. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2023;33(1):77-83. (In Russian)] https://doi.org/10.22416/1382-4376-2023-33-1-77-83
11. Журкова Н.В., Вашакмадзе Н.Д., Сурков А.Н., Смирнова О.Я., Сергиенко Н.С., Овсяник Н.Г., Селимзянова Л.Р. Нарушения митохондриального бета-окисления жирных кислот у детей: обзор литературы. Вопросы современной педиатрии. 2022;21(6S):522-528. [Zhurkova N.V., Vashakmadze N.D., Surkov A.N., Smirnova O.Ya., Sergienko N.S., Ovsyanik N.G., Selimzyanova L.R. Disorders of mitochondrial beta-oxidation of fatty acids in children: a review of the literature. Issues of modern pediatrics. 2022;21(6S):522-528. (In Russian)] https://doi.org/10.15690/vsp.v21i6S.2503
12. Печатникова Н.Л., Краснощекова Н.А., Какаулина В.С. Диетотерапия при нарушениях митохондриального бета-окисления длинноцепочечных жирных кислот и опыт применения специализированной смеси Lipano® у детей с дефицитом длинноцепочечной 3-гидрокси-ацилКоА-дегидрогеназы жирных кислот. Медицинская генетика. 2022;21(1):44-50. [Pechatnikova N.L., Krasnoshchekova N.A., Kakaulina V.S. Diet therapy for disorders of mitochondrial beta-oxidation of long-chain fatty acids and experience with the use of a specialized mixture Lipano® in children with deficiency of long-chain 3-hydroxy-acylCoA dehydrogenase of fatty acids. Medical genetics. 2022;21(1):44-50. (In Russian)] https://doi.org/10.25557/2073-7998.2022.01.44-50
13. Мазунин И.О. Особенности митохондриальных заболеваний. Педиатрический вестник Южного Урала. 2012; (1): 86-88. [Mazunin I.O. Features of mitochondrial diseases. Pediatric Bulletin of the Southern Urals. 2012; (1): 86-88. (In Russian)]
14. Захарова И.Н., Горяйнова А.Н., Майкова И.Д., Короид Н.В., Катасонова Л.П., Елфимова О.И., Кузина Н.Е., Дикова Е.А. Лизосомные болезни накопления липидов у детей. Современные способы диагностики и лечения. Медицинский Совет. 2016;1(1):128-135. [Zakharova I.N., Goryaynova A.N., Maykova I.D., Koroid N.V., Katasonova L.P., Elfimova O.I., Kuzina N.E., Dikova E.A. Lysosomal lipid storage diseases in children. Modern methods of diagnosis and treatment. Medical advice. 2016;1(1):128-135. (In Russian)] https://doi.org/10.21518/2079-701X-2016-1-128-135
15. Сквoрцoв В.В., Гoрбaч А.Н. Поражение печени при болезнях накопления. Эффективная фармакотерапия. 2020; (16) 24:64–67. [Skvortsov V.V., Gorbach A.N. Liver damage due to storage diseases. Effective pharmacotherapy. 2020; (16) 24:64–67. (In Russian)] DOI 10.33978/2307-3586-2020-16-24-64-67
16. Семячкина А.Н., Новиков П.В., Воскобоева Е.Ю., Захарова Е.Ю., Букина Т.М., Смирнова Г.В., Цветкова И.В. Мукополисахаридозы у детей. Российский вестник перинатологии и педиатрии. 2007; 52 (4): 22-29. [Semyachkina A.N., Novikov P.V., Voskoboeva E.Yu., Zakharova E.Yu., Bukina T.M., Smirnova G.V., Tsvetkova I.V. Mucopolysaccharidoses in children. Russian Bulletin of Perinatology and Pediatrics. 2007; 52 (4): 22-29 (In Russian)]
17. Chornyi S, IJlst L, van Roermund CWT, Wanders RJA, Waterham HR. Peroxisomal Metabolite and Cofactor Transport in Humans. Front Cell Dev Biol. 2021 Jan 11;8:613892. doi: 10.3389/fcell.2020.613892.
18. Visser W.F., van Roermund C.W., Ijlst L., Waterham H.R., Wanders R.J. Metabolite transport across the peroxisomal membrane. Biochem. J. 2007, 401: 365-375
19. Wanders RJ, Waterham HR, Ferdinandusse S. Metabolic Interplay between Peroxisomes and Other Subcellular Organelles Including Mitochondria and the Endoplasmic Reticulum. Front Cell Dev Biol. 2016 Jan 28;3:83. doi: 10.3389/fcell.2015.00083
20. Ахмадеев А.Р., Муслимова Е.В., Апакова М.А., Терехова С.Н. Острая перемежающаяся порфирия (описание случая). Практическая медицина. 2011; 55:168-169. [Akhmadeev A.R., Muslimova E.V., Apakova M.A., Terekhova S.N. Acute intermittent porphyria (case description). Practical medicine. 2011; 55:168-169. (In Russian)]
21. Перепелица С.А., Седнев О.В. Патогенетическая роль нарушения обмена холестерина и триглицеридов в развитии критических состояний. Общая реаниматология. 2015; 11 (5): 67-74. [Perepelitsa S.A., Sednev O.V. Pathogenetic role of cholesterol and triglyceride metabolism disorders in the development of critical conditions. General resuscitation. 2015; 11 (5): 67-74.In Russian)]
22. Иванов Д.О., Новикова В.П., Похлебкина А.А.Врожденные нарушения гликозилирования. Педиатр. 2018; 9 (3): 5-15. [Ivanov D.O., Novikova V.P., Pokhlebkina A.A. Congenital disorders of glycosylation. Pediatrician. 2018; 9 (3): 5-15 (In Russian)]
23. Омельченко Е.В., Ермолаев М.Н., Сенаторова А.С., Шипко А.Ф., Омельченко-Селюкова А.В., Ермолаева М.М., Левченко Ю.А. Артериопеченочная дисплазия (синдром Алажиля) у ребенка (клиническое наблюдение). ЗР. 2015; (62). [Omelchenko E.V., Ermolaev M.N., Senatorova A.S., Shipko A.F., Omelchenko-Selyukova A.V., Ermolaeva M.M., Levchenko Yu.A. Arteriohepatic dysplasia (Alagille syndrome) in a child (clinical observation). ZR. 2015; (62). (In Russian)] URL: https://cyberleninka.ru/article/n/arteriopechenochnaya-displaziya-sindrom-alazhilya-u-rebenka-klinicheskoe-nablyudenie (дата обращения: 07.02.2024).
24. Ильченко Л.Ю., Федоров И.Г., Тотолян Г.Г., Цветкова А.Г., Гавриленко Е.Г., Миронов К.О., Никитин И.Г. Наследственная неконъюгированная гипербилирубинемия (сочетание синдрома Криглера-Найяра II типа и синдрома Жильбера). Гепатология и гастроэнтерология. 2021; 5 (1): 79-84. [Ilchenko L.Yu., Fedorov I.G., Totolyan G.G., Tsvetkova A.G., Gavrilenko E.G., Mironov K.O., Nikitin I.G. Hereditary unconjugated hyperbilirubinemia (combination of Crigler-Najjar syndrome type II and Gilbert's syndrome). Hepatology and gastroenterology. 2021; 5 (1): 79-84. (In Russian)] https://doi.org/10.25298/2616-5546-2021-5-1-79-84
25. Каганов Б. С., Строкова Т. В., Мачулан И. В., Каменец Е. А., Захарова Е. Ю. Случай синдрома Байлера. ЭиКГ. 2012; (1). [Kaganov B. S., Strokova T. V., Machulan I. V., Kamenets E. A., Zakharova E. Yu. A case of Byler's syndrome. EiKG. 2012; (1). (In Russian)] URL: https://cyberleninka.ru/article/n/sluchay-sindroma-baylera (дата обращения: 07.02.2024).
26. Литвицкий Петр Францевич Расстройства липидного обмена. ВСП. 2012; (6). [Litvitsky Petr Frantsevich Disorders of lipid metabolism. VSP. 2012; (6). (In Russian)] URL: https://cyberleninka.ru/article/n/rasstroystva-lipidnogo-obmena (дата обращения: 07.02.2024).
27. Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease metaanalytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. [(In Russian)] https://doi.org/10.1002/hep.28431
28. Полякова С.И., Смирнов И.Е., Задкова Г.Ф., Ходунова Т.В. Диагностика и лечение абеталипопротеинемии (клинический случай). Российский педиатрический журнал. 2012; (4). [Polyakova S.I., Smirnov I.E., Zadkova G.F., Khodunova T.V. Diagnosis and treatment of abetalipoproteinemia (clinical case). Russian pediatric journal. 2012; (4). (In Russian)] URL: https://cyberleninka.ru/article/n/diagnostika-i-lechenie-abetalipoproteinemii-klinicheskiy-sluchay (дата обращения: 07.02.2024).
29. Ларшина Е.А., Милованова Н.В., Каменец Е.А. Недостаточность альфа-1-антитрипсина: диагностика и лечение (обзор литературы). Медицинская генетика. 2021;20(1):12-24. [Larshina E.A., Milovanova N.V., Kamenets E.A. Alpha-1-antitrypsin deficiency: diagnosis and treatment (literature review). Medical genetics. 2021;20(1):12-24. (In Russian)] https://doi.org/10.25557/2073-7998.2021.01.12-24
30. Ткачук Е.А., Семинский И.Ж. Методы современной генетики. Байкальский медицинский журнал. 2023;2(1):60-71. [Tkachuk E.A., Seminsky I.Zh. Methods of modern genetics. Baikal Medical Journal. 2023;2(1):60-71. (In Russian)] https://doi.org/10.57256/2949-0715-2023-1-60-71
Об авторах
Елена Анатольевна ТкачукФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России, Россия, 664001, г. Иркутск, ул. Красного Восстания, 1; ФГБНУ Научный центр проблем здоровья семьи и репродукции человека, Россия, 664001, г. Иркутск, ул. Тимирязева, 16; ФГБНУ Восточно-Сибирский институт медико-экологических исследований, Россия, 665827, г. Ангарск, микрорайон 12а, дом 3.
Россия
д.м.н., доцент, профессор кафедры патологической физиологии и клинической лабораторной диагностики ФГБОУ ВО ИГМУ Минздрава России;
старший научный сотрудник ФГБНУ НЦПЗСЧР;
ведущий научный сотрудник ФГБНУ ВСИМЭИ
Игорь Жанович Семинский
Россия
д.м.н., профессор, заведующий кафедрой патологической физиологии и клинической лабораторной диагностики ФГБОУ ВО ИГМУ Минздрава России
Рецензия
Для цитирования:
Ткачук Е.А., Семинский И.Ж. НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ, ПРОТЕКАЮЩИЕ С ПОРАЖЕНИЕМ ПЕЧЕНИ (ЛЕКЦИЯ). Байкальский медицинский журнал. 2024;3(1):78-95. https://doi.org/10.57256/2949-0715-2024-1-78-95
For citation:
Tkachuk E.A., Seminsky I.Zh. HEREDITARY DISEASES OCCURRING WITH LIVER DAMAGE (LECTURE). Baikal Medical Journal. 2024;3(1):78-95. (In Russ.) https://doi.org/10.57256/2949-0715-2024-1-78-95
















